
【題目】下列物質在水溶液中的電離方程式正確的是
A.H2CO3 ![]() 2H+ + CO32-B.NH3·H2O=NH4+ + OH-
2H+ + CO32-B.NH3·H2O=NH4+ + OH-
C.MgCl2 ═ Mg2+ + Cl2-D.NaHSO4 ═ Na+ + H+ + SO42-
科目:高中化學 來源: 題型:
【題目】將一定量的CO2氣體通入2L的NaOH溶液中,在所得溶液中逐滴加入稀鹽酸至過量,并將溶液加熱,產生的氣體與消耗的HCl物質的量關系如圖所示(忽略氣體的溶解和HCl的揮發)。下列說法不正確的是( )
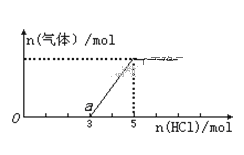
A.通入CO2氣體的體積在標準狀況下為22.4 L
B.O到a點發生反應的離子方程式:H++OH—=H2O、CO32—+H+=HCO3—
C.O點溶液中所含溶質的化學式為NaOH、Na2CO3
D.NaOH溶液的物質的量濃度為2.5 molL—1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質,不能按如圖(“→”表示反應一步完成)關系轉化的是

選 項 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4超干重整CO2技術可得到富含CO的化工原料。回答下列問題:
(1)CH4超干重整CO2的催化轉化如圖所示:
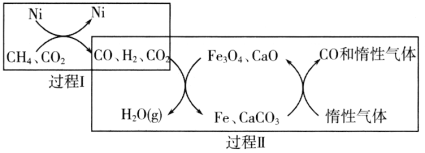
①已知相關反應的能量變化如圖所示:

過程Ⅰ的熱化學方程式為________。
②關于上述過程Ⅱ的說法不正確的是________(填序號)。
a.實現了含碳物質與含氫物質的分離
b.可表示為CO2+H2=H2O(g)+CO
c.CO未參與反應
d.Fe3O4、CaO為催化劑,降低了反應的ΔH
③其他條件不變,在不同催化劑(Ⅰ、Ⅱ、Ⅲ)作用下,反應CH4(g)+CO2(g)=2CO(g)+2H2(g)進行相同時間后,CH4的轉化率隨反應溫度的變化如圖所示。a點所代表的狀態________(填“是”或“不是”)平衡狀態;b點CH4的轉化率高于c點,原因是________。
(2)在一剛性密閉容器中,CH4和CO2的分壓分別為20kPa、25kPa,加入Ni/α-Al2O3催化劑并加熱至1123K使其發生反應CH4(g)+CO2(g)=2CO(g)+2H2(g)。

①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某時刻測得p(CO)=20kPa,則p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
②達到平衡后測得體系壓強是起始時的1.8倍,則該反應的平衡常數的計算式為Kp=________(kPa)2。(用各物質的分壓代替物質的量濃度計算)
(3)CH4超干重整CO2得到的CO經偶聯反應可制得草酸(H2C2O4)。常溫下,向某濃度的草酸溶液中加入一定濃度的NaOH溶液,所得溶液中![]() ,則此時溶液的pH=________。(已知常溫下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
,則此時溶液的pH=________。(已知常溫下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】國際計量大會新修訂了阿伏加德羅常數(NA=6.02214076×1023mol1),并于2019年5月20日正式生效。下列有關NA說法正確的是
A. 22.4LCH2=CH2CH3分子中含碳碳雙鍵的數目為NA
B. 17g羥基(﹣OH)所含的電子總數為9NA
C. 64 g S2和S8混合物中含硫原子總數為NA
D. 1L0.5mol·L1FeCl3溶液中Cl-數目小于1.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(10分)某同學幫助水質檢測站配制480 mL 0.5 mol·L-1NaOH溶液以備使用。
(1)該同學應選擇________mL的容量瓶。
(2)其操作步驟如下圖所示,
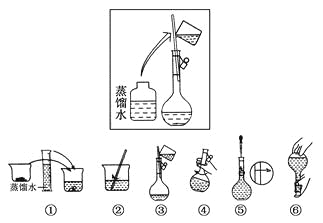
則如圖操作應在下圖中的________(填選項字母)之間。
A.②與③ B.①與② C.④與⑤
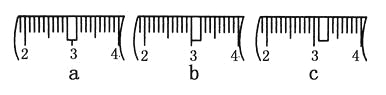
(3)該同學應稱取NaOH固體________g,用質量為23.1 g的燒杯放在托盤天平上稱取所需NaOH固體時,請在附表中選取所需的砝碼大小________(填字母),并在下圖中選出能正確表示游碼位置的選項________(填字母)。
附表 砝碼規格
a | b | c | d | e | |
砝碼大小/g | 100 | 50 | 20 | 10 | 5 |
(4)下列操作對所配溶液的濃度大小有何影響?
①轉移完溶液后未洗滌玻璃棒和燒杯,濃度會________(填“偏大”、“偏小”或“無影響”,下同)
②容量瓶中原來有少量蒸餾水,濃度會________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應3A(g)+B(g)![]() 2C(g)+2D(s)在2 L密閉容器中進行,經過4min,B減少了0.4 mol,則0~4min內此反應的平均速率為
2C(g)+2D(s)在2 L密閉容器中進行,經過4min,B減少了0.4 mol,則0~4min內此反應的平均速率為
A. v(A)=0.15 mol·L1B. v(B)=0.05 mol·L1·s1
C. v(C)=0.10 mol·L1·min1D. v(D)=0.10 mol·L1·min1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏德羅常數,下列敘述正確的是( )
A. 標準狀況下,22.4L H2O含有的分子數為 NA
B. 通常狀況下,NA 個CO2分子占有的體積為22.4L
C. 物質的量濃度為1mol/L的MgCl2溶液中,含有Cl—個數為2NA
D. 常溫常壓下,1.06g Na2CO3含有的Na+離子數為0.02 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘及其化合物在生活中應用廣泛,含有碘離子的溶液需回收處理。
(1)“硫碘循環”法是分解水制備氫氣的研究熱點,涉及下列三個反應:
反應Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH1
反應Ⅱ:HI(aq)=![]() H2(g)+
H2(g)+![]() I2(aq) ΔH2
I2(aq) ΔH2
反應Ⅲ:2H2SO4(aq)=2SO2(g)+O2(g)+2H2O(l)
①反應:SO2(g)+2H2O(l)=H2SO4(aq)+H2(g)的ΔH=___(用ΔH1、ΔH2表示)。
②分析上述反應,下列判斷正確的是___
a.反應Ⅲ易在常溫下進行 b.反應Ⅰ中SO2還原性比HI強
c.循環過程中需補充H2O d.循環過程中產生1molO2同時產生1molH2
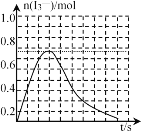
③反應I發生時,溶液中存在如下平衡:I2(aq)+I-(aq)![]() I3-(aq),其反應速率極快且平衡常數大。現將1molSO2緩緩通入含1molI2的水溶液中至恰好完全反應。溶液中I3-的物質的量n(I3-)隨反應時間(t)的變化曲線如圖所示。開始階段n(I3-)逐漸增大的原因是___。
I3-(aq),其反應速率極快且平衡常數大。現將1molSO2緩緩通入含1molI2的水溶液中至恰好完全反應。溶液中I3-的物質的量n(I3-)隨反應時間(t)的變化曲線如圖所示。開始階段n(I3-)逐漸增大的原因是___。
(2)用海帶提取碘時,需用氯氣將碘離子氧化成單質。酸性條件下,若氯氣過量就能將碘單質進一步氧化成碘酸根離子(IO3-),寫出氯氣與碘單質反應的離子方程式:___。
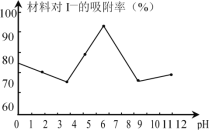
(3)科研小組用新型材料Ag/TiO2對溶液中碘離子進行吸附研究。如圖是不同pH條件下,碘離子吸附效果的變化曲線。據此推斷Ag/TiO2材料最適合吸附___(填“酸性”“中性”或“堿性”)溶液中的I-。
(4)氯化銀復合吸附劑也可有效吸附碘離子。氯化銀復合吸附劑對碘離子的吸附反應為I-(aq)+AgCl(s)![]() AgI(s)+Cl-(aq),反應達到平衡后溶液中c(I-)=___[用c(Cl-)、Ksp(AgCl)和Ksq(AgI)表示]。該方法去除碘離子的原理是___。
AgI(s)+Cl-(aq),反應達到平衡后溶液中c(I-)=___[用c(Cl-)、Ksp(AgCl)和Ksq(AgI)表示]。該方法去除碘離子的原理是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com