
【題目】利用氯堿工業中的離子交換膜技術原理,可電解Na2SO4溶液生產NaOH溶液和H2SO4溶液。下列說法中正確的是
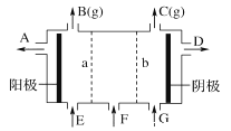
A. 陰極反應式為4OH--4e-=2H2O+O2↑
B. 從A口出來的是NaOH溶液
C. b是陽離子交換膜,允許Na+通過
D. Na2SO4溶液從G口加入
 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案科目:高中化學 來源: 題型:
【題目】將35g鋅粉與少量濃硫酸在加熱條件下充分反應,共收集到混合氣體11.2L(標準狀況),其質量為19.6g,則剩余鋅粉的質量為
A. 1.0g B. 2.0g C. 2.5g D. 3.5g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種主族元素的離子![]() 、
、![]() 、
、![]() 、
、![]() (a、b、c、d 為元素的原子序數),它們具有相同的電子層結構,若 m>n,對下列敘述的判斷正確的是( )
(a、b、c、d 為元素的原子序數),它們具有相同的電子層結構,若 m>n,對下列敘述的判斷正確的是( )
①a-b=n-m ②元素的原子序數 a>b>c>d ③元素非金屬性 Z>R ④最高價氧化物對應水化物堿性 X>Y
A.③B.①②③④C.①②③D.②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據報道,我國擁有完全自主產權的氫氧燃料電池車將在北京奧運會期間為運動員提供服務。某種氫氧燃料電池的電解液為KOH溶液,下列有關該電池的敘述不正確的是( )
A. 正極反應式為:O2+2H2O+4e-====4OH-
B. 工作一段時間后,電解液中KOH的物質的量不變
C. 該燃料電池的總反應方程式為:2H2+O2====2H2O
D. 用該電池電解CuCl2溶液,產生2.24 L Cl2(標準狀況)時,有0.1 mol電子轉移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量混合氣體在密閉容器中發生如下反應![]() ;ΔH <0,達到平衡后測得A氣體的濃度為0.5mol·L-1;當恒溫下將密閉容器的容積擴大兩倍并再次達到平衡時,測得A的濃度為0.3 mol·L-1。則下列敘述正確的是( )
;ΔH <0,達到平衡后測得A氣體的濃度為0.5mol·L-1;當恒溫下將密閉容器的容積擴大兩倍并再次達到平衡時,測得A的濃度為0.3 mol·L-1。則下列敘述正確的是( )
A. 平衡向右移動 B. x+y>z C. B的轉化率提高 D. C的體積分數增加
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常見氣體在標準狀況下的密度為1.25 g·L-1。
(1)該氣體的相對分子質量為________。
(2)若該氣體的分子式為A2型,其名稱為________;
若該氣體的分子式為AB型,其名稱為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗能獲得成功的是 ( )
A. 用溴水可鑒別苯、乙醇、苯乙烯![]()
B. 加濃溴水,然后過濾可除去苯中少量乙烯
C. 苯、溴水、鐵粉混合制成溴苯
D. 可用分液漏斗分離硝基苯和苯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KIO3是一種重要的無機化合物,可作為食鹽中的補碘劑。回答下列問題:
(1)KIO3的化學名稱是_______。
(2)利用“KClO3氧化法”制備KIO3工藝流程如下圖所示:

“酸化反應”所得產物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“濾液”中的溶質主要是_______。“調pH”中發生反應的化學方程式為__________。
(3)KIO3也可采用“電解法”制備,裝置如圖所示。
①寫出電解時陰極的電極反應式______。
②電解過程中通過陽離子交換膜的離子主要為_________,其遷移方向是_____________。
③與“電解法”相比,“KClO3氧化法”的主要不足之處有______________(寫出一點)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關阿伏加德羅常數NA的說法正確的是( )
A. 標準狀況下,5.6 L CO2與足量Na2O2反應轉移的電子數為0.5NA
B. 常溫常壓下,11gCO2中含有0.75NA個原子
C. 標準狀況下,NA個水分子的體積約為22.4L
D. 50 mL 12 mol·L-1鹽酸與足量MnO2共熱,轉移的電子數為0.3NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com