
【題目】環氧乙烷常用于一次性口罩生產過程中滅菌和新冠病毒的消殺,工業上常利用乙烯直接氧化法生產環氧乙烷(![]() ),發生的反應如下。
),發生的反應如下。
主反應Ⅰ:2CH2=CH2(g)+O2(g)![]() 2
2![]() (g)
(g) ![]() =-210kJ·mol-1
=-210kJ·mol-1
副反應Ⅱ:CH2=CH2(g)+3O2(g)![]() 2CO2(g)+2H2O)(l)
2CO2(g)+2H2O)(l)![]() =-1324kJ·mol-1
=-1324kJ·mol-1
Ⅲ.2![]() (g)+5O2(g)
(g)+5O2(g)![]() 4CO2(g)+4H2O(g)
4CO2(g)+4H2O(g)![]()
已知:環氧乙烷選擇性是指乙烯進行反應Ⅰ生成環氧乙烷的優勢。
(1)![]() =_________kJ·mol-1。
=_________kJ·mol-1。
(2)①圖1是乙烯轉化率、環氧乙烷選擇性與流速關系的圖象,圖中隨進料氣的流速加快,乙烯的轉化率下降,其可能原因是_________________。

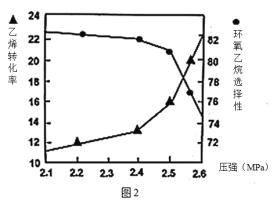
②圖2是乙烯轉化率、環氧乙烷選擇性與壓強關系的圖象,圖中當反應體系的壓強高于2.4MPa,環氧乙烷選擇性下降,其可能原因是__________________。
(3)實驗測得反應Ⅰ中,v正=K正·x2(CH2=CH2)·x(O2),v逆=K逆·x2(![]() ),(式中x為物質的量分數;K正、K逆為速率常數,只與溫度有關)。
),(式中x為物質的量分數;K正、K逆為速率常數,只與溫度有關)。
①若在1L的密閉容器中充2molCH2=CH2(g)和1molO2(g),在一定溫度下只發生反應,達到平衡時CH2=CH2的轉化率為75%,則該反應平衡常數的值為___________。
②若平衡后僅升高溫度,則下列說法正確的是___________。
a.x(CH2=CH2)增大,x(![]() )減小
)減小
b.K正與K逆的比值增大
c.v正減小,v逆增大
d.K正與K逆的比值減小
(4)將乙烯與飽和食鹽水的電解產物反應,轉化為氯乙醇[CH2(OH)CH2C],氯乙醇進一步反應生成環氧乙烷,其電解簡易裝置如右圖所示。
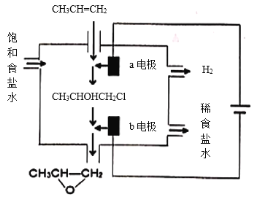
已知:CH2=CH2+H2O+Cl2→CH2(OH)CH2Cl+HCl
①a電極為___________(選填“陰極”或“陽極”)。
②b電極區域生成環氧乙烷的化學方程式為______________________。
【答案】-2438 流速越快,反應物接觸時間越短,原料氣與催化劑接觸時間也短,消耗乙烯的量越少,導致乙烯轉化率下降。 壓強增大,主、副反應速率增加,使反應體系升溫,可能導致副反應速率比主反應速率增大的快,使環氧乙烷的選擇性降低;壓強增大副反應Ⅲ的平衡逆移,環氧乙烷濃度增大,不利于反應Ⅰ正向進行,故環氧乙烷選擇性降低 36 ad 陽極 CH2(OH)CH2Cl + NaOH→![]() + NaCl + H2O
+ NaCl + H2O
【解析】
(1)主反應①:2CH2=CH2(g)+O2(g)2![]() (g)△H1=-210.0kJmol-1
(g)△H1=-210.0kJmol-1
副反應②:CH2=CH2(g)+3O2(g)2CO2(g)+2H2O(g)△H2=-1324.0kJmol-1
根據蓋斯定律計算②×2-①得到2![]() (g)+5O2(g)4CO2(g)+4H2O(g)的△H3=[2×(-1324.0)+210.0]kJ/mol=-2438kJ/mol;
(g)+5O2(g)4CO2(g)+4H2O(g)的△H3=[2×(-1324.0)+210.0]kJ/mol=-2438kJ/mol;
答案為-2438。
(2)①流速越快,反應物接觸時間越短,原料氣與催化劑接觸時間也短,消耗乙烯的量越少,導致乙烯轉化率下降;
答案為流速越快,反應物接觸時間越短,原料氣與催化劑接觸時間也短,消耗乙烯的量越少,導致乙烯轉化率下降。
②I.壓強增大,主、副反應速率增加,使反應體系升溫,可能導致副反應速率比主反應速率增大的快,使環氧乙烷的選擇性降低;II.壓強增大,副反應③逆向移動,環氧乙烷濃度增大,不利于反應①的進行,使環氧乙烷的選擇性降低;
故答案為壓強增大,主、副反應速率增加,從而導致反應體系升溫;溫度升高導致副反應速率比主反應速率提高的更多,環氧乙烷的選擇性降低;壓強增大,副反應③逆向移動,環氧乙烷濃度增大,導致反應①進行不利,環氧乙烷選擇性降低。
(3)①在1L的密閉容器中充2molCH2=CH2(g)和1molO2(g),在一定溫度下發生反應,達到平衡時CH2=CH2的轉化率為75%,則由反應2CH2=CH2(g)+O2(g)2![]() 可知,平衡時,c(CH2=CH2)=0.5mol/L,c(O2)=0.25mol/L,c(
可知,平衡時,c(CH2=CH2)=0.5mol/L,c(O2)=0.25mol/L,c(![]() )=1.5mol/L,則平衡常數K=
)=1.5mol/L,則平衡常數K=![]() =36;
=36;
答案為36。
②a.若平衡后僅升高溫度,因為該反應2CH2=CH2(g)+O2(g)2![]() (g)△H1=-210.0kJmol-1,是放熱反應,平衡逆向移動,則x(CH2=CH2)增大,x(
(g)△H1=-210.0kJmol-1,是放熱反應,平衡逆向移動,則x(CH2=CH2)增大,x(![]() )減小,故a正確;
)減小,故a正確;
b.正反應為放熱反應,升高溫度,平衡逆向移動,則k正增大的倍數<k逆增大的倍數,k正與k逆比值變小,故b錯誤;
c.升高溫度,V正,V逆均增大,故c錯誤;
d.正反應為放熱反應,升高溫度,平衡逆向移動,則k正增大的倍數<k逆增大的倍數,k正與k逆比值變小,故d正確;
答案為ad。
(4)①a連接電源正極,應為電解池陽極;
答案為陽極。
②b為陰極,生成NaOH,CH2(OH)CH2Cl與氫氧化鈉溶液反應生成環氧乙烷、NaCl和水,方程式為CH2(OH)CH2Cl + NaOH→ ![]() + NaCl + H2O;
+ NaCl + H2O;
答案為CH2(OH)CH2Cl + NaOH→![]() + NaCl + H2O。
+ NaCl + H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】鋁土礦(主要成分為Al2O3,還含有SiO2、Fe2O3)是工業上制備氧化鋁的主要原料。工業上提取氧化鋁的工藝流程如下:
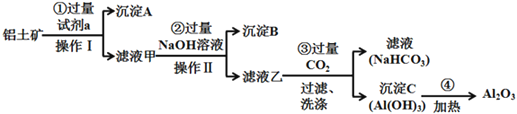
(1)沉淀A的成分是(填化學式)_________。
(2)步驟②中加入過量NaOH溶液發生反應的離子方程式,除了H++OH-=H2O還有:
_____________________________、________________________________;
(3)步驟③中通入過量CO2氣體的離子方程式有______________________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至過量。經測定,加入的NaOH的物質的量(mol)和所得沉淀的物質的量(mol)的關系如下圖所示。
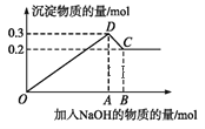
(1)寫出下列線段內發生反應的離子方程式:
OD段_________________________,
CD段_________________________。
(2)原溶液中Mg2+、Al3+的物質的量濃度之比為____________。
(3)圖中C點橫坐標為_______ 。
(4)圖中線段OA∶AB=____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】制備N2H4·H2O(水合肼)和無水Na2SO3主要實驗流程如下:

已知:① 氯氣與燒堿溶液的反應是放熱反應;
② N2H4·H2O有強還原性,能與NaClO劇烈反應生成N2。
⑴從流程分析,本流程所用的主要有機原料為_______________(寫名稱)。
⑵步驟Ⅰ制備NaClO溶液時,若溫度為41℃,測得產物中除NaClO外還含有NaClO3,且兩者物質的量之比為5∶1,該反應的離子方程式為____________________。
⑶實驗中,為使步驟Ⅰ中反應溫度不高于40 ℃,除減緩Cl2的通入速率外,還可采取的措施是_________________。
⑷步驟Ⅱ合成N2H4·H2O(沸點約118 ℃)的裝置如圖。NaClO堿性溶液與尿素[CO(NH2)2](沸點196.6℃)水溶液在40℃以下反應一段時間后,再迅速升溫至110℃繼續反應。

① 使用冷凝管的目的是_________________。
② 滴液漏斗內的試劑是_______;
將滴液漏斗內的液體放入三頸燒瓶內的操作是______________________________;
③ 寫出流程中生成水合肼反應的化學方程式________________________________。
⑸ 步驟Ⅳ制備無水Na2SO3(水溶液中H2SO3、HSO3-、SO32-隨pH的分布如圖所示)。

① 邊攪拌邊向Na2CO3溶液中通入SO2制備NaHSO3溶液。實驗中確定停止通SO2的pH值為____(取近似整數值,下同);
②用制得的NaHSO3溶液再制Na2SO3溶液的pH應控制在________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向10mL0.1mol·L-1KCl溶液和10mL0.1mol·L-1K2CrO4溶液中分別滴加0.1mol·L-1AgNO3溶液。滴加過程中pM[表示-lgc(Cl-)或-lgc(CrO42-)]與所加AgNO3溶液體積之間的關系如下圖所示。已知Ag2CrO4為磚紅色沉淀,下列說法不合理的是
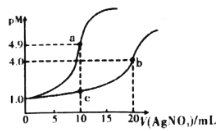
A.bc所在曲線對應K2CrO4溶液
B.常溫下,Ksp(Ag2CrO4)<Ksp(AgCl)
C.溶液中c(Ag+)的大小:a點>b點
D.用0.1mol·L-1AgNO3標準液滴定上述KCl、K2CrO4溶液時,Cl-先沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸鉛(PbSO4)廣泛應用于制造鉛蓄電池、白色顏料等。工業生產中利用方鉛礦(主要成分為PbS,含有FeS2等雜質)和軟錳礦(主要成分為MnO2)制備PbSO4的工藝流程如圖:
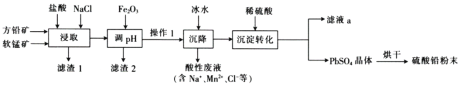
已知:i.PbCl2難溶于冷水,易溶于熱水。
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) ΔH>0
PbCl42-(aq) ΔH>0
iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5。
(1)“浸取”時需要加熱,此時鹽酸與MnO2、PbS發生反應生成PbCl2和S的化學方程式為__。
(2)“調pH”的目的是__。
(3)“沉降”操作時加入冰水的作用是__。
(4)![]() 時,PbCl2(s)在不同濃度的鹽酸中的最大溶解量(g·L-1)如圖所示。下列敘述正確的是__(填字母)。
時,PbCl2(s)在不同濃度的鹽酸中的最大溶解量(g·L-1)如圖所示。下列敘述正確的是__(填字母)。

A.鹽酸濃度越小,Ksp(PbCl2)越小
B.x、y兩點對應的溶液中c(Pb2+)不相等
C.當鹽酸濃度為1mol·L-1時,溶液中c(Pb2+)一定最小
D.當鹽酸濃度小于1mol·L-1時,隨著HCl濃度的增大,PbCl2溶解量減小是因為Cl-濃度增大使PbCl2溶解平衡逆向移動
(5)PbCl2經“沉淀轉化”后得到PbSO4,當c(Cl-)=0.1mol·L-1時,c(SO42-)=__。
(6)“濾液a”經過處理后可以返回到__工序循環使用。利用制備的硫酸鉛與氫氧化鈉反應制備目前用量最大的熱穩定劑三鹽基硫酸鉛(3PbO·PbSO4·H2O),該反應的化學方程式為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室以V2O5為原料制備氧釩(Ⅳ)堿式碳酸銨晶體{(NH4)5[(VO)6(CO3)4(OH)9] ·10H2O},其流程如圖:
V2O5![]() VOCl2溶液
VOCl2溶液![]() 氧釩(Ⅳ)堿式碳酸銨晶體
氧釩(Ⅳ)堿式碳酸銨晶體
(1)“還原”過程中的還原劑是__(填化學式)。
(2)已知VO2+能被O2氧化,“轉化”可在如圖裝置中進行。

①儀器M的名稱是__,實驗開始前的操作是__。
②裝置B的作用是__。
③加完VOCl2溶液后繼續攪拌一段時間,使反應完全,再進行下列操作,順序為__(填字母)。
a.錐形瓶口塞上橡膠塞
b.取下P
c.將錐形瓶置于干燥器中,靜置過濾
④得到紫紅色晶體,抽濾,并用飽和NH4HCO3溶液洗滌3次,用無水乙醇洗滌2次,再用乙醚洗滌2次,抽干稱重。用飽和NH4HCO3溶液洗滌除去的陰離子主要是__(填離子符號),用無水乙醇洗滌的目的是__。
⑤稱量mg產品于錐形瓶中,用20mL蒸餾水與30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍過量,充分反應后繼續滴加1%的NaNO2溶液至稍過量,再用尿素除去過量NaNO2,最后用cmol·L-1(NH4)2Fe(SO4)2標準溶液滴定至終點(已知滴定反應為VO2++Fe2++2H+=VO2++Fe3++H2O),消耗標準溶液的體積為VmL。若(NH4)2Fe(SO4)2標準溶液部分變質,會使測定結果___(填“偏高”“偏低”或“無影響”),產品中釩的質量分數為__(以VO2+的量進行計算,列出計算式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵和氧化鐵的混合物共2mol,加鹽酸后固體全部溶解,共收集到0.5molH2,且溶液中加入KSCN溶液不顯紅色,則原混合物中鐵的物質的量為
A.0.5molB.1.5molC.0.75molD.1.25mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com