
【題目】次氯酸鈉是常見的消毒劑,實驗室可用以下兩種方法來制取次氯酸鈉溶液:
方法一:向裝有NaOH的溶液中通入氯氣(裝置如圖所示);

方法二:向Na2CO3溶液中加入Ca(ClO)2,反應后過濾。
(1)寫出方法一所發生反應的離子方程式___。
(2)NaOH溶液和氯氣的反應為放熱反應,隨著溫度的升高,會有副反應發生。為防止副反應的發生,可以采取的方法是___。
(3)方法二與方法一相比,優點除無副反應發生外,還有___、___。
(4)某次氯酸鈉粗產品中混有的雜質為NaClO3,為測定粗產品中NaClO的質量分數,現進行如下實驗:稱取0.6173g樣品于錐形瓶中,加水使樣品完全溶解,向溶液中加入適量硫酸酸化,接著加入40mL0.5000mol·L-1的FeSO4溶液(過量),充分反應。再向錐形瓶中滴加0.0200mol·L-1的KMnO4溶液,恰好完全反應時消耗KMnO4溶液體積28.00mL。請計算樣品中NaClO的質量分數(寫出計算過程)。___
已知實驗過程中發生的反應如下:
H++ClO-+Fe2+→Cl-+Fe3++H2O
H++ClO3-+Fe2+→Cl-+Fe3++H2O
H++MnO4-+Fe2+→Mn2++Fe3++H2O(以上反應均未配平)
【答案】Cl2+2OH-=ClO-+Cl-+H2O 將燒杯置于冰水浴中(或緩慢通入Cl2) 不使用有毒物質,不會污染空氣 不含雜質(或雜質少) 96.55%
【解析】
(1)方法一為向裝有NaOH的溶液中通入氯氣,氯氣和氫氧化鈉反應生成氯離子和次氯酸跟,離子方程式為:Cl2+2OH-=ClO-+Cl-+H2O;
(2)要減少副反應的發生就是要降低反應體系的溫度,方法有緩慢滴加鹽酸、將裝置C置于冰水中;
(3)方法二向Na2CO3溶液中加入Ca(ClO)2,沒有使用有毒氣體氯氣,不會污染空氣,并且生成物除次氯酸鈉還有碳酸鈣沉淀,容易出去,雜質少;
(4)消耗KMnO4物質的量:0.0200mol·L-1×0.028L=0.00056mol,由得失電子守恒可知與高錳酸鉀反應的Fe2+物質的量:0.00056mol×5=0.0028mol,總物質的量:0.5000mol·L-1×0.04L=0.02mol,與樣品反應的Fe2+總物質的量,0.02mol-0.0028mol=0.0172mol,極限法討論:0.6173g樣品全為NaClO,2n(NaClO)=n(Fe2+)=2×(0.6173g÷74.5g/mol)=0.01657mol,0.6173g樣品全為NaClO3,6n(NaClO3)=n(Fe2+)=6×(0.6173g÷106.5g/mol)=0.03478mol,0.6173g樣品全為NaCl,不消耗Fe2+,故樣品中含的雜質為NaClO3,列方程得:74.5 n(NaClO)+106.5 n(NaClO3)=0.6173,2n(NaClO)+6 n(NaClO3)=0.0172,解方程可以求得n(NaClO)。
(1)方法一為向裝有NaOH的溶液中通入氯氣,氯氣和氫氧化鈉反應生成氯離子和次氯酸跟,離子方程式為:Cl2+2OH-=ClO-+Cl-+H2O;
(2)要減少副反應的發生就是要降低反應體系的溫度,方法有緩慢滴加鹽酸、將裝置C置于冰水中;
(3)方法二向Na2CO3溶液中加入Ca(ClO)2,沒有使用有毒氣體氯氣,不會污染空氣,并且生成物除次氯酸鈉還有碳酸鈣沉淀,容易出去,雜質少,故答案為:不使用有毒物質,不會污染空氣;
(4)消耗KMnO4物質的量:0.0200mol·L-1×0.028L=0.00056mol,由得失電子守恒可知與高錳酸鉀反應的Fe2+物質的量:0.00056mol×5=0.0028mol,總物質的量:0.5000mol·L-1×0.04L=0.02mol,與樣品反應的Fe2+總物質的量,0.02mol-0.0028mol=0.0172mol,極限法討論:0.6173g樣品全為NaClO,2n(NaClO)=n(Fe2+)=2×(0.6173g÷74.5g/mol)=0.01657mol,0.6173g樣品全為NaClO3,6n(NaClO3)=n(Fe2+)=6×(0.6173g÷106.5g/mol)=0.03478mol,0.6173g樣品全為NaCl,不消耗Fe2+,故樣品中含的雜質為NaClO3,列方程得:74.5 n(NaClO)+106.5 n(NaClO3)=0.6173,2n(NaClO)+6 n(NaClO3)=0.0172,解得n(NaClO)=0.008
W(NaClO)=(![]() )×100%=96.55%;
)×100%=96.55%;


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:
【題目】藥物阿莫西林能殺滅或抑制細菌繁殖,它的合成路線如下:
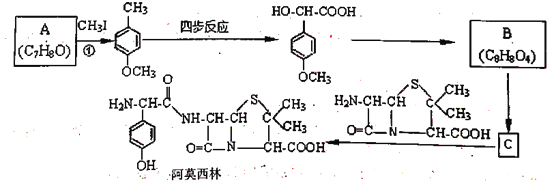
已知:1.兩個羥基同時連在同一個碳原子上的結構是不穩定的,它將發生脫水反應
![]()
![]()
![]() +H2O
+H2O
2.RCHO![]()
![]()
![]()
![]()
(1)關于阿莫西林分子,下列說法正確的是_______________。
A.分子式為C16H18N3O5 B.分子中含4個手性碳原子
C.1 mol該物質最多能與3mol NaOH反應 D.能發生取代、加成、氧化、縮聚等反應
(2)反應①的化學方程式為_______________,CH3I的作用為__________。
(3)寫出甘氨酸(H2N-CH2-COOH)和C發生縮合生成二肽的結構簡式: ________。
(4)試寫出3種同時滿足下列條件的化合物C的同分異構體:___________。
①分子中含苯環,不含過氧鍵“-O-O-”;
②分子中含有3種不同化學環境的氫原子。
(5)利用己有知識和題中涉及的反應,設計從 的路線。(用流程圖表示,無機試劑任選)__________________
的路線。(用流程圖表示,無機試劑任選)__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)根據官能團可以對有機物進行分類、鑒別和除雜。
①下列有機物屬于烴的是___(填字母)。
a.乙炔 b.乙醇 c.乙酸
②區分甲苯和苯,可用的試劑是___(填字母)。
a.FeCl3溶液 b.酸性KMnO4溶液 c.溴水
③除去乙酸乙酯中的乙酸,可用的試劑是___(填字母)。
a.NaOH溶液 b.NaCl溶液 c.飽和Na2CO3溶液
(2)異丙苯是一種重要的有機化工原料。異丙苯的結構簡式為![]() 。
。
①異丙苯中最多有___個碳原子共平面,其核磁共振氫譜上有___個峰。
②異丙苯氧化后可制取分子式為C6H6O的芳香族化合物,該化合物的結構簡式是___。
③異丙苯制備對溴異丙苯的化學方程式為___。
(3)化合物III是一種合成醫藥的中間體,其合成路線如下:
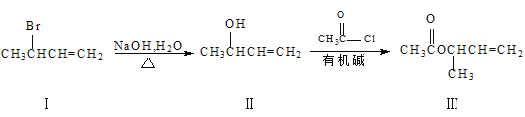
①III中所含官能團的名稱是___和___。
②該合成路線中第二步反應屬于___反應(填反應類型)。
③I、Ⅱ、Ⅲ三種物質中,與濃硫酸共熱能得到CH2=CHCH=CH2的是___(填序號)。物質Ⅱ在Cu作催化劑及加熱條件下與O2反應可得產物為___。
④Ⅲ的一種同分異構體X能發生銀鏡反應,不能發生水解反應,分子中有3種不同化學環境的氫。X的結構簡式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在某恒容的密閉容器中,建立化學平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列敘述不能說明該反應已達到化學平衡狀態的是( )
CO(g)+H2(g)。下列敘述不能說明該反應已達到化學平衡狀態的是( )
A.體系的壓強不再發生變化
B.v正(CO)=v逆(H2O)
C.生成nmolCO,同時生成nmolH2
D.斷裂1molH—H鍵的同時斷裂2molH—O鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相同溫度下,體積均為0.25L的兩個恒容密閉容器中發生可逆反應:X2(g) + 3Y2(g) ![]() 2XY3(g) △H=-92.6kJ/mol
2XY3(g) △H=-92.6kJ/mol
實驗測得反應在起始、達到平衡時的有關數據如下表所示:
容器 編號 | 起始時各物質物質的量/mol | 達平衡時體系能量的變化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q kJ |
下列敘述正確的是
A. 容器①、②中反應的平衡常數不相等
B. 達平衡時,兩個容器中XY3的物質的量濃度均為2 mol/L
C. 容器②中反應達到平衡時放出的熱量為23.15kJ
D. 若容器①體積為0.20 L,則達平衡時放出的熱量小于23.15 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在體積固定的密閉容器中,加入2molA和1molB發生下列反應并且達到化學平衡狀態,2A(g)+B(g) ![]() 3C(g)+D(g),平衡時C的濃度為amol·L-1。若維持容器體積和溫度不變,按下列4種方法配比作為起始物質充入該容器中,達到平衡后,C的濃度仍為amol·L-1的是( )
3C(g)+D(g),平衡時C的濃度為amol·L-1。若維持容器體積和溫度不變,按下列4種方法配比作為起始物質充入該容器中,達到平衡后,C的濃度仍為amol·L-1的是( )
A.4molA+2molB B.3molC+1molB+1molD+1molA
C.2molA+1molB+1molD D.1molA+0.5molB + 1.5molC+0.5molD
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2.0mol PCl3和1.0mol Cl2充入體積不變的密閉容器中,在一定條件下發生下述反應: PCl3(g)+Cl2(g)![]() PCl5(g)達平衡時,PCl5為0.40mol,如果此時再移走1.0mol PCl3和0.50mol Cl2,在相同溫度下再達平衡時PCl5的物質的量是( )
PCl5(g)達平衡時,PCl5為0.40mol,如果此時再移走1.0mol PCl3和0.50mol Cl2,在相同溫度下再達平衡時PCl5的物質的量是( )
A.0.40molB.0.20mol
C.小于0.20molD.大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在恒容密閉容器中發生如下反應:2A(g)+B(g)![]() 3C(g),若反應開始時充入2 mol A和2 mol B,達平衡后A的體積分數為a%。其他條件不變時,若按下列四種配比作為起始物質,平衡后A的體積分數大于a%的是
3C(g),若反應開始時充入2 mol A和2 mol B,達平衡后A的體積分數為a%。其他條件不變時,若按下列四種配比作為起始物質,平衡后A的體積分數大于a%的是
A. 2.5mol C B. 2 mol A、2 mol B和10 mol He(不參加反應)
C. 1.5 mol B和1.5 mol C D. 2 mol A、3 mol B和3 mol C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列依據熱化學方程式得出的結論正確的是
A.已知NaOH(aq)+HCl(aq)=![]()
![]() H=-57.3
H=-57.3![]() 則含40.0 g NaOH的稀溶液與稀醋酸完全中和,放出小于57.3 kJ的熱量
則含40.0 g NaOH的稀溶液與稀醋酸完全中和,放出小于57.3 kJ的熱量
B.已知2H2(g)+O2(g)=2H2O(g) ![]() H=-483.6
H=-483.6![]()
![]() 則氫氣的燃燒熱為241.8
則氫氣的燃燒熱為241.8![]()
C.已知![]() =
=![]()
![]() H=a
H=a![]()
![]() ===2CO(g)
===2CO(g)![]() H=b
H=b![]() 則a>b
則a>b
D.已知P(白磷,s)=P(紅磷,s)![]() H<0,則白磷比紅磷穩定
H<0,則白磷比紅磷穩定
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com