
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
 ,離子半徑最大的是S 2-.
,離子半徑最大的是S 2-.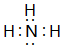 ;⑤的一種氧化物呈淡黃色,其含有的化學鍵類型有離子鍵和共價鍵,電子式為
;⑤的一種氧化物呈淡黃色,其含有的化學鍵類型有離子鍵和共價鍵,電子式為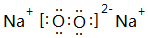 .
. 分析 根據元素在周期表中的位置知,①~⑩分別是H、N、O、F、Na、Mg、Al、S、Cl、K元素,
(1)同一周期元素,原子半徑隨著原子序數增大而減小;氯原子得電子生成氯離子,所以氯離子核外有18個電子、核內質子數是17;離子電子層數越多其離子半徑越大,電子層結構相同的離子,離子半徑隨著原子序數增大而減小;
(2)元素的非金屬性越強,其最高價氧化物的水化物酸性越強,但O、F元素除外;元素的金屬性越強,其最高價氧化物的水化物堿性越強;
(3)⑤和⑦的最高價氧化物對應水化物分別是NaOH、Al(OH)3,二者反應生成NaAlO2和水;
(4)氨氣分子中N原子和每個H原子形成1個共用電子對,且N原子還有一個孤電子對;過氧化鈉中存在離子鍵和共價鍵,鈉離子和過氧根離子之間存在離子鍵、O-O原子之間存在共價鍵.
解答 解:根據元素在周期表中的位置知,①~⑩分別是H、N、O、F、Na、Mg、Al、S、Cl、K元素,
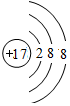
(1)同一周期元素,原子半徑隨著原子序數增大而減小,則⑤~⑨元素位于同一周期,原子半徑最小的是Cl;氯原子得電子生成氯離子,所以氯離子核外有18個電子、核內質子數是17,氯離子原子結構示意圖為 ;離子電子層數越多其離子半徑越大,電子層結構相同的離子,離子半徑隨著原子序數增大而減小,所以離子半徑最大的是S 2-,
;離子電子層數越多其離子半徑越大,電子層結構相同的離子,離子半徑隨著原子序數增大而減小,所以離子半徑最大的是S 2-,
故答案為:Cl; ;S 2-;
;S 2-;
(2)元素的非金屬性越強,其最高價氧化物的水化物酸性越強,但O、F元素除外,則除了O、F元素外非金屬性最強的元素是Cl元素,則酸性最強的是HClO4;元素的金屬性越強,其最高價氧化物的水化物堿性越強,金屬性最強的是K元素,其最高價氧化物的水化物堿性最強的是KOH,
故答案為:HClO4;KOH;
(3)⑤和⑦的最高價氧化物對應水化物分別是NaOH、Al(OH)3,二者反應生成NaAlO2和水,離子方程式為OH-+Al(OH)3=AlO2-+2H2O,
故答案為:OH-+Al(OH)3=AlO2-+2H2O;
(4)氨氣分子中N原子和每個H原子形成1個共用電子對,且N原子還有一個孤電子對,電子式為 ;過氧化鈉中存在離子鍵和共價鍵,鈉離子和過氧根離子之間存在離子鍵、O-O原子之間存在共價鍵,電子式為
;過氧化鈉中存在離子鍵和共價鍵,鈉離子和過氧根離子之間存在離子鍵、O-O原子之間存在共價鍵,電子式為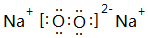 ,
,
故答案為: ;離子鍵和共價鍵;
;離子鍵和共價鍵;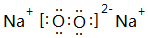 .
.
點評 本題考查元素周期表和元素周期律的綜合應用,為高頻考點,明確原子結構、元素周期表結構及元素周期律是解本題關鍵,涉及化學用語、離子方程式書寫、元素周期律等知識點,注意元素周期律中特殊現象,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 若△H<0,△S>0,任何溫度下都能自發進行 | |
| B. | 若△H>0,△S<0,任何溫度下都不能自發進行 | |
| C. | 需要加熱才能夠進行的過程肯定不是自發過程 | |
| D. | 非自發過程在一定條件下可能變成自發過程 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
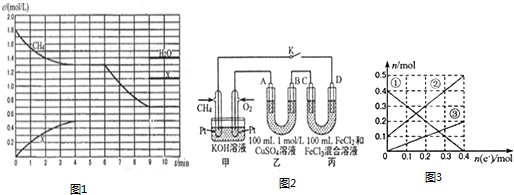
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
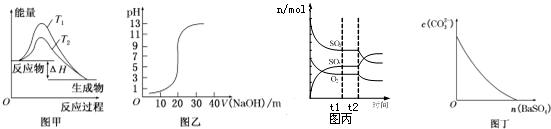
| A. | 圖甲表示溫度T1>T2,SO2與O2反應過程中的能量變化 | |
| B. | 圖乙表示0.100 0 mol/L NaOH溶液滴定20.00ml 0.100 0 mol/L CH3COOH溶液所得到的滴定曲線 | |
| C. | 圖丙表示一定條件下進行的反應2SO2+O2?2SO3各成分的物質的量變化,t2時刻改變的條件可能是縮小容器體積 | |
| D. | 圖丁表示在飽和Na2CO3溶液中逐步加BaSO4固體后,溶液中c(CO32-)濃度變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t℃ | 400 | 500 | 800 | 1000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等物質的量的硫蒸氣和硫固體分別完全燃燒,后者放出熱量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若將含0.5 mol H2SO4的濃硫酸與含1 mol NaOH的溶液混合,放出的熱量大于57.3 kJ | |
| C. | 由C(石墨)═C(金剛石)△H=1.90 kJ•mol-1可知,金剛石比石墨穩定 | |
| D. | 在100 kPa時,2 g H2完全燃燒生成液態水,放出285.8 kJ熱量,則H2燃燒的熱化學方程式為2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向沸水中滴加FeCl3溶液制備Fe(OH)3膠體:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 澄清石灰水與稀鹽酸反應Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 稀硫酸除鐵銹:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 硫酸和Ba(OH)2反應:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com