
【題目】按要求填空
(1)根據官能團的不同對下列有機物進行分類:(填序號)
①CH3CH2OH② ![]() ③CH3CH2Br④
③CH3CH2Br④ ![]() ⑤
⑤ ![]() ⑥
⑥ 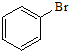 ⑦
⑦ ![]() ⑧
⑧ ![]() ⑨
⑨  ⑩
⑩ 
屬于芳香烴的是 ;屬于鹵代烴的是 ;屬于醇的是 ;屬于酚的是 ;屬于醛的是 ;屬于酮的是 ;屬于羧酸的是 ;屬于酯的是 .
(2)有機化學中的反應類型較多,將下列反應歸類:(填序號)
①乙烯使酸性高錳酸鉀溶液褪色 ②由乙烯制備聚乙烯
③甲烷與氯氣在光照條件下的反應 ④由乙炔制氯乙烯
屬于取代反應的是 ;屬于加成反應的是 ;屬于加聚反應的是 ;屬于氧化反應的是 .
【答案】
(1)⑨;③⑥;①;⑤;⑦;②;⑧⑩;④
(2)③;④;②;①
【解析】解:(1)芳香烴是只含有苯環,且只含有C、H元素得化合物,故⑨符合;
鹵代烴是用鹵素原子取代了烴中的氫原子的化合物,故③⑥符合;
羥基連接在脂肪烴基上為醇類物質,故①符合;
羥基連接在苯環上為酚,⑤符合;
醛基與氫原子或鏈烴基或苯環相連的化合物,屬于醛類,故⑦符合;
羰基與鏈烴基或苯環相連的化合物為酮,故②符合;
羧基與鏈烴基或苯環或氫原子相連的化合物,為羧酸,故⑧⑩符合;
含有酯基的化合物,屬于酯類物質,故④符合.
所以答案是:⑨;③⑥;①;⑤;⑦;②;⑧⑩;④;(2)①乙烯含有碳碳雙鍵,能被高錳酸鉀溶液氧化,從而高錳酸鉀被還原而使酸性高錳酸鉀溶液褪色,故此反應為氧化反應;
②由乙烯制備聚乙烯是由小分子單體制取了高分子化合物,是加聚反應;
③甲烷與氯氣在光照的條件下氫原子被氯原子取代,屬于取代反應;
④由乙炔制氯乙烯,是乙炔中的三鍵斷開一條后與HCl中的H和Cl發生加成反應.
所以答案是:③; ④; ②; ①.
【考點精析】關于本題考查的聚合反應與酯化反應,需要了解聚合反應是通過加成聚合反應形成高分子化合物,特征是生成物只有高分子化合物,其組成與單體相同;酯化反應是酸與醇起作用、生成酯和水的反應才能得出正確答案.


科目:高中化學 來源: 題型:
【題目】下列物質的沸點由高到低排列的順序是 ( )
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3 ⑤(CH3CH2)2CHCl.
A.⑤②④①③
B.④②⑤①③
C.⑤④②①③
D.②④⑤③①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質中,在一定條件下既能進行加成反應,也能進行取代反應,并且不能使KMnO4酸性溶液褪色的是( )
A. 乙烷B. 乙烯C. 乙炔D. 苯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組實驗中溶液最先變渾濁的是( )
A.0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反應溫度 10℃
B.0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反應溫度 10℃
C.0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反應溫度 30℃
D.0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反應溫度 30℃
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在Na2CO3和HCl反應的下列各組實驗中,反應速率最快的一組是
組號 | 溫度(℃) | Na2CO3濃度(mol/L) | HCl濃度(mol/L) |
A | 20 | 0.1 | 0.2 |
B | 20 | 0.2 | 0.2 |
C | 10 | 0.2 | 0.4 |
D | 20 | 0.2 | 0.4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】若往20mL 0.01molL﹣l HNO2(弱酸)溶液中逐滴加入一定濃度的燒堿溶液,測得混合溶液的溫度變化如圖所示,下列有關說法不正確的是( ) 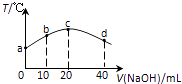
A.HNO2的電離平衡常數:c點>b點
B.b點混合溶液顯酸性:c(Na+)>c(NO2﹣)>c(H+)>c(OH﹣)
C.c點混合溶液中:c(OH﹣)>c(HNO2)
D.d點混合溶液中:c(Na+)>c(OH﹣)>c(NO2﹣)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硅單質及其化合物應用范圍很廣.請回答下列問題
(1)制備硅半導體材料必須先得到高純硅的主要方法,其生產過程示意圖如圖所示. 
①寫出由純SiHCl3制備高純硅的化學反應方程式
②整個制備過程必須嚴格控制無水無氧.SiHCl3遇水劇烈反應生成H2SiO3、HCl和另一種物質,寫出配平的化學反應方程式,H2還原SiHCl3過程中若混入O2 , 可能引起的后果是 .
(2)硅酸鈉水溶液俗稱水玻璃.取少量硅酸鈉溶液于試管中,逐滴加入飽和氯化銨溶液,振蕩.寫出實驗現象其產生原因: .
①2O2(g)+N2(g)=N2O4 , (l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3
④2N2 H4 (1)+N2O4 (1)=3N2 (g)+4H2O(g)△H4=﹣1048.9kJ/mol
上述反應熱效應之間的關系式為△H4= , 聯氨和N2O4可作為火箭助推劑,折算在標準狀況下的數據,燃爆后氣體的體積與燃爆前的體積之比為:
N2H4 | N2O4 | |
密度/g/cm3 | 1.004 | 1.44 |
(3)聯氨為二元弱減,在水中的電離方程式與氨相似,聯氨第一步電離反應的平衡常數值為(已知:N2H4+H+N2H5+的K=8.7×107;KW=1.0×10﹣14),.聯氨與硫酸形成的酸式鹽的化學式為 .
(4)聯氨是一種常用的還原劑.向裝有少量AgBr的試管中加入聯氨溶液,觀察到的現象是 . 聯氨可用于處理鍋爐水中的氧;防止鍋爐被腐蝕,理論上1kg的聯氨可除去水中溶解的O2kg;與使用Na2SO3處理水中溶解的O2相比,聯氨的優點是 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com