
【題目】為了探究化學能與熱能的轉化,某實驗小組設計了如下三套實驗裝置:

(1)上述裝置中,不能證明“鋅和稀硫酸反應是吸熱反應還是放熱反應”的是 _________(填序號)
(2)某同學選用裝置Ⅰ進行實驗(實驗前U形管里液面左右相平),在甲試管里加入適量氫氧化鋇晶體與氯化銨固體攪拌反應,U形管中可觀察到的現象是___________________________________________________________________________________________
(3)為探究固體M溶于水的熱效應,選擇裝置Ⅱ進行實驗(反應在甲中進行)。
①若觀察到燒杯里的玻璃管內形成一段水柱,則說明M溶于水________________ (填“一定是放熱反應”“一定是吸熱反應”或“可能是放熱反應”或“可能是吸熱反應”),理由____________。
②若觀察到燒杯里產生氣泡,則M可能是__________________(填一種物質的化學式)
【答案】Ⅲ 左端液柱升高,右端液柱降低 可能是吸熱反應 某些物質溶于水吸熱,但不是發生化學反應 NaOH、CaO等
【解析】
(1)Ⅲ的漏斗不封閉,不會形成壓強差,不能證明“鋅和稀硫酸反應是吸熱反應還是放熱反應”,故答案為:Ⅲ;
(2)氫氧化鋇晶體與氯化銨的反應為吸熱反應,反應開始,錐形瓶內溫度降低,壓強減小,大氣壓將“U”形管中的紅墨水往左邊擠壓,出現左端液柱升高,右端液柱降低的現象,故答案為:左端液柱升高,右端液柱降低;
(3)①燒杯里的玻璃管內形成一段水柱,說明M與水相遇吸熱。某些物質溶解于水吸熱,如硝酸銨,某些物質與水反應吸熱,如鹽類水解,所以,燒杯里的玻璃管內形成一段水柱,可能是M溶解于水吸熱,也可能是發生了吸熱反應,故答案為:可能是吸熱反應;某些物質溶于水吸熱,但不是發生化學反應;
②若觀察到燒杯里產生氣泡,說明M與水相遇放熱,可能是某些物質溶解于水放熱,如NaOH,也可能是某些物質與水反應放熱,如CaO,故答案為:NaOH、CaO等。


科目:高中化學 來源: 題型:
【題目】①CH3CH2CH3 ②CH3CH2CH2CH3 ③CH3CH2CH2CH2CH3 ④![]()
⑤ ⑥CH3CH2CH2CH2CH2CH3
⑥CH3CH2CH2CH2CH2CH3
上述物質的沸點按由高到低的順序排列的是( )
A. ⑥③④⑤②① B. ⑥③②①④⑤ C. ⑤④⑥③②① D. ⑥⑤④③②①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】當電池工作時,下列說法錯誤的

A. 甲池中N極的電極反應式為:O2+4e-+4H+=2H2O
B. 當N極消耗5.6L(標準狀況下)O2時,鐵極增重32g
C. 電子的流動方向為M→Fe→CuSO4溶液→Cu→N
D. M極上發生的是氧化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D為短周期主族元素并且原子序數依次增大,其中只有A、B、C在同一周期。A元素原子核外成對電子數是未成對電子數的2倍;B元素最外層有3個未成對電子;C元素核外有3對成對電子;D元素是所在周期中原子半徑最小的;E元素位于周期表的第四周期第九列。請根據相關信息,應化學用語回答下列問題:
(1)A的基態原子核中核外有___種運動狀態不同的電子;B的基態原子中電子占據最高能級的電子云輪廓圖為____。D的基態原子核外有____種能量不同的電子。
(2)B的氫化物BH3的VSEPR模型為____,其分子空間構型為_____;A、B、C三種元素的第一電離能由大到小的順序為_____(填元素符號)。
(3)BO2-中B原子的雜化軌道類型為____;與AB-互為等電子體的分子有_____,離子有_____。(分別寫出1種)
(4)由A、C與氫形成H2A2C4分子中,1mol該分子中含有π鍵的數目為____。
(5)E元素位于元素周期表中的___區,E3+的一種配離子[E(BH3)5D]2+中,E3+的配位數為____,配位原子為____、____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅合金以純銅為基體加入一種或幾種其他元素所構成的合金,是人類使用最早的金屬材料。
(1)電解精煉銅的實驗中使用的粗銅含有Cu和少量的Zn、Ag、Au、Cu2Te及其他化合物,請寫出電解精煉銅時,陽極發生的電極反應式__________、______________。
(2)從粗銅精煉的陽極泥(主要含有Cu2Te)中提取粗碲的一種工藝流程如圖:(已知TeO2是兩性氧化物,微溶于水,易溶于強酸和強堿)
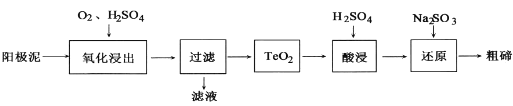
①“氧化浸出”時為使碲元素沉淀充分應控制溶液的pH為4.5~5.0,生成TeO2沉淀。如果H2SO4過量,溶液酸度過大,將導致碲沉淀不完全,原因是_____.
②“過濾”用到的玻璃儀器有____。
③“還原”時發生的離子方程式是________。
④判斷粗碲洗凈的方法是_________。
⑤在濾液中逐滴加入氨水至過量,先出現藍色沉淀,最后溶解形成深藍色的透明溶液。寫出此藍色沉淀溶解的離子方程式_______。根據以上實驗判斷NH3和H2O與Cu2+的配位能力:NH3_____H2O(填“>”或“=”或“<”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化硫的催化氧化原理為2SO2(g)+O2(g)![]() 2SO3(g)。在一定壓強下,反應混合體系在平衡狀態時SO3的百分含量與溫度的關系如圖所示。下列說法不正確的是
2SO3(g)。在一定壓強下,反應混合體系在平衡狀態時SO3的百分含量與溫度的關系如圖所示。下列說法不正確的是
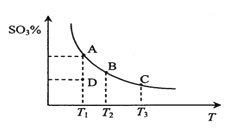
A. 反應2SO2(g)+O2(g)![]() 2SO3(g)的△H<0
2SO3(g)的△H<0
B. 在D點時v(正)<v(逆)
C. 若B、C點的平衡常數分別為KB、KC,則KB>KC
D. 恒溫恒壓下向平衡體系中通入氦氣,平衡向左移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】300℃時,將氣體X和氣體Y各0.16 mol充入10 L恒容密閉容器中,發生反應:X(g) +Y(g)![]() 2Z(g) ΔH<0,一段時間后達到平衡。反應過程中測定的數據如下表:
2Z(g) ΔH<0,一段時間后達到平衡。反應過程中測定的數據如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
回答下列問題:
(1)反應0~2 min Z的平均速率v(Z)=_____________
(2)能判斷該反應已經達到平衡狀態的是_____________
A.生成X的速率是生成Z的速率的2倍
B.容器內壓強保持不變
C.容器內氣體的密度保持不變
D.容器內各氣體的濃度保持不變
(3)要提高上述反應的轉化率,可采取的措施是_____________(任寫一種)。
(4)溫度為300℃時,該反應的化學平衡常數K=_______________
(5)若起始時向該容器中充入X、Y、Z各0.20 mol,則反應將向____(填“正”或“逆”)反應方向進行,達平衡時Z的體積分數與上述平衡相比______(填“增大”、“減小”或“不變”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)如圖為CO2分子晶體結構的一部分,觀察圖形。試說明每個 CO2分子周圍有________個與之緊鄰且等距的 CO2分子;該結構單元平均占有________個CO2分子。

(2)在40 GPa高壓下,用激光器加熱到1800 K時,人們成功制得原子晶體干冰,其結構和性質與SiO2原子晶體相似,下列說法正確的是________。
A.原子晶體干冰易升華,可用作制冷劑
B.原子晶體干冰有很高的熔點和沸點
C.原子晶體干冰的硬度小,不能用作耐磨材料
D.原子晶體干冰在一定條件下可與氫氧化鈉反應
E.每摩爾原子晶體干冰中含有4 mol C—O鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列各組物質:(以下各題請按要求填寫相應編號)
A.O2和O3 B.![]() C和
C和![]() C C.
C C.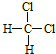 和
和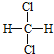 D.CH3CH2CH2CH3和
D.CH3CH2CH2CH3和 E.甲烷和庚烷 F.CH(CH3)3和C(CH3)4 G.C3H8和C10H22 H.CH2=CH2和CH3CH=CH2 I.H2和D2 J.C3H6和C5H10
E.甲烷和庚烷 F.CH(CH3)3和C(CH3)4 G.C3H8和C10H22 H.CH2=CH2和CH3CH=CH2 I.H2和D2 J.C3H6和C5H10
(1)___組互為同位素;
(2)___組兩物質互為同素異形體;
(3)___組兩物質互為同系物;
(4)___組兩組物質互為同分異構體;
(5)___組中的物質是同一物質。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com