
化學反應在工農(nóng)業(yè)生產(chǎn)中有著重要的應用。按要求回答下列問題:
(1)利用化學反應可以制備許多物質(zhì)。
①實驗室用銅制備NO的離子方程式為___________________。
②可用Al和Fe2O3制Fe,該反應的化學方程式為___________________。
③海水提溴過程中,向濃縮的海水中通入氯氣,再用熱空氣吹出生成的溴,然后用碳酸鈉溶液吸收溴,溴歧化為Br-和BrO3-。這兩步反應的離子方程式分別為__________、___________。
(2)化學反應能為人類生產(chǎn)生活提供能源。
①由反應CH4
+2O2 CO2
+2H2O,可以設計出以NaOH溶液為電解質(zhì)溶液的燃料電池,該電池工作時負極的電極反應式為:______________。
CO2
+2H2O,可以設計出以NaOH溶液為電解質(zhì)溶液的燃料電池,該電池工作時負極的電極反應式為:______________。
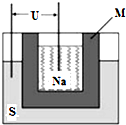
②2011年山東高考化學中曾提到鈉硫高能電池,右圖是該電池的結構示意圖,該電池的工作溫度為320℃左右,電池反應為2Na+xS=Na2Sx。該電池負極為________(填化學式),正極的電極反應式為 。用該電池作電源進行粗銅精煉時,當?shù)玫?4g精銅時,理論上該電池負極消耗的質(zhì)量為_____g。

(1)①3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
②2Al+Fe2O3 2Fe+Al2O3;(缺少條件減1分)
2Fe+Al2O3;(缺少條件減1分)
③2Br-+Cl2=2Cl-+Br2,3Br2+3CO32-=5Br-+BrO3-+3CO2↑
(2)①CH4+10OH--8e-=CO32-+7H2O;②Na,xS+2e-=Sx2-,46
【解析】
試題分析:(1)①硝酸具有強氧化性,能和金屬銅發(fā)生氧化還原反應,因此可用于稀硝酸與銅反應制備NO,反應的離子方程式為3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
②鋁是活潑的金屬,可以通過鋁熱反應冶煉金屬,所以可用Al和Fe2O3制Fe,該反應的化學方程式為2Al+Fe2O3 2Fe+Al2O3。
2Fe+Al2O3。
③氯氣氧化性強于單質(zhì)溴的,所以氯氣能把溴離子氧化生成單質(zhì)溴,反應的離子方程式為2Br-+Cl2=2Cl-+Br2。單質(zhì)溴溶于水顯酸性,能和碳酸鈉溶液發(fā)生歧化反應生成NaBr、NaBrO3和水,反應的離子方程式為3Br2+3CO32-=5Br-+BrO3-+3CO2↑。
(2)①原電池中負極失去電子,發(fā)生氧化反應。正極得到電子發(fā)生還原反應,則根據(jù)反應CH4 +2O2 CO2 +2H2O可知,還原劑是甲烷,氧氣是氧化劑,所以如果設計成原電池,則氧氣在正極通入,甲烷在負極通入。由于電解質(zhì)溶液是氫氧化鈉溶液,所以負極電極反應式為CH4+10OH--8e-=CO32-+7H2O。
CO2 +2H2O可知,還原劑是甲烷,氧氣是氧化劑,所以如果設計成原電池,則氧氣在正極通入,甲烷在負極通入。由于電解質(zhì)溶液是氫氧化鈉溶液,所以負極電極反應式為CH4+10OH--8e-=CO32-+7H2O。
②原電池中負極失去電子,發(fā)生氧化反應。正極得到電子發(fā)生還原反應,則根據(jù)電池反應為2Na+xS=Na2Sx可知,鈉是還原劑,所以該電池負極為Na。正極是S得到電子,則正極電極反應式為xS+2e-=Sx2-。64g銅的物質(zhì)的量=64g÷64g/mol=1mol,根據(jù)電極反應式Cu2++2e-=Cu可知,轉(zhuǎn)移2mol電子,所以根據(jù)電子守恒可知,負極消耗金屬鈉的物質(zhì)的量是2mol,質(zhì)量=2mol×23g/mol=46g。
考點:考查物質(zhì)的性質(zhì)、方程式的書寫;電化學原理的有關判斷、應用與計算


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案科目:高中化學 來源: 題型:
| 實驗組 | 溫度/℃ | 起始量/mol | 2分鐘/mol | 平衡常數(shù) | |
| H2 | N2 | NH3 | |||
| 1 | 298 | 6 | 2 | 1.2 | 4.1×106 |
| 2 | 398 | 3 | 1 | 0.8 | K1 |
| [c(NH3)]2 |
| c(N2)[c(H2)]3 |
| [c(NH3)]2 |
| c(N2)[c(H2)]3 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| T/K | 298 | 398 | 498 |
| K | 4.1×106 | K1 | K2 |

| O |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| ||
| (一定條件) |
 2NH3(g),△H<0,其化學平衡常數(shù)K與t的關系如下表:(已知K=
2NH3(g),△H<0,其化學平衡常數(shù)K與t的關系如下表:(已知K=| C(N2)?[C (H2) ]3 |
| [C (NH3)]2 |
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:
 化學反應在工農(nóng)業(yè)生產(chǎn)中有著重要的應用.按要求回答下列問題:
化學反應在工農(nóng)業(yè)生產(chǎn)中有著重要的應用.按要求回答下列問題:
| ||
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com