解答:解:(1)根據質量守恒定律及反應方程式知,該反應反應前后氣體的物質的量不變,氣體的質量變小,所以平均摩爾質量減小,溫度升高,平衡時混合氣體的平均相對摩爾質量減小,說明平衡向正反應方向移動,所以正反應是吸熱反應,
故答案為:吸熱;
(2)A.反應前后氣體的物質的量不變,所以不能用壓強判斷平衡,故A錯誤;
B.反應前后氣體體積不變,氣體的質量減少,所以密度減小,所以容器內氣體密度不再發生變化即是平衡狀態,故B正確;
C.隨著反應進行,C分子逐漸增多,所以容器內氣體C的分子總數不再發生變化即是平衡狀態,故C正確;
D.相同時間內消耗2nmolA的同時消耗nmolB,都是向正方向進行,所以不能判斷平衡狀態,故D錯誤;
E.相同時間內生成2nmolA為正反應,同時生成3nmolC為逆反應,而且反應的比值等于計量數之比,所以能判斷平衡,故E正確;
故答案為:BCE;
(3)根據等效平衡,把物質都換算成方程式一邊的物質,且和初始加入的入2mol A和1mol B相等即可.
①4mol A+2mol B 與初始A、B濃度不同,故錯誤;
②3molC+l mol D+1mol B換算成A、B,A、B濃度分別為2mol、2mol,與初始濃度不同,故錯誤;
③3mol C+2mol D 換算成A、B,A、B濃度分別為2mol、1mol,D是固體,對氣體無影響,故正確;
④1.6molA+0.8 mol B+0.6mol C 與初始濃度相比,增大了C,平衡逆移,但是C的濃度增大,故錯誤;
⑤2mol A+1mol B+1molHe,體積恒定,加入稀有氣體,平衡不移動,所以加入1molHe無影響,A、B濃度分別為2mol、1mol與初始濃度相同,故正確;
故答案為:③⑤;
(4)2A(g)+B(g)
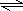
3C(g)+D(S),
C、D未反應 0 0 3mol 0.8 mol
D完全反應 1.6mol 0.8 mol 0.6mol 0
CD未反應時容器的體積V=
=
=2.5L;
D完全反應時容器的體積V=
=
=0.5L;
即體積為0.5L<V<2.5L,故答案為:0.5;2.5.

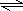 3C(g)+D(S),
3C(g)+D(S),

 新思維假期作業寒假吉林大學出版社系列答案
新思維假期作業寒假吉林大學出版社系列答案