
X、Y、Z、Q、R是五種短周期元素,原子序數依次增大。X、Y兩元素最高正價與最低負價之和均為0;Q與X同主族;Z、R分別是地殼中含量最高的非金屬元素和金屬元素。請回答下列問題:
(1)五種元素原子半徑由大到小的順序是(寫元素符號) 。
(2)由以上某些元素組成的化合物A、B、C、D有如下轉化關系: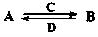 (在水溶液中進行)其中,C是溶于水顯酸性的氣體;D是淡黃色固體。寫出C的結構式: ;D的電子式: 。
(在水溶液中進行)其中,C是溶于水顯酸性的氣體;D是淡黃色固體。寫出C的結構式: ;D的電子式: 。
①如果A、B均由三種元素組成,B為兩性不溶物,則A的化學式為 ;由A轉化為B的離子方程式為 。
②如果A由三種元素組成,B由四種元素組成,A、B溶液均顯堿性。用離子方程式表示A溶液顯堿性的原因: 。常溫下,A、B濃度均為0.1mol·L-1的混合溶液中,在該溶液中滴加稀鹽酸至中性時,溶質的主要成分有 。
解析試題分析:X、Y、Z、Q、R是五種短周期元素,原子序數依次增大。X、Y兩元素最高正價與最低負價之和均為0,且Q與X同主族,則X、Q處于ⅠA族,Y處于ⅣA族,則X為碳元素,故X為氫元素,Q為Na元素,Y為碳元素;Z、R分別是地殼中含量最高的非金屬元素和金屬元素,則Z為氧元素、R為Al元素,(1)同周期自左而右原子半徑減小,電子層越多原子半徑越大,故原子半徑Na>Al>C>O>H,故答案為:Na>Al>C>O>H;(2)由以上某些元素組成的化合物A、B、C、D有如下轉化關系: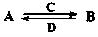 (在水溶液中進行),其中,C是溶于水顯酸性的氣體,則C為CO2,D是淡黃色固體則D為Na2O2,則:CO2的結構式為O=C=O,Na2O2的電子式為
(在水溶液中進行),其中,C是溶于水顯酸性的氣體,則C為CO2,D是淡黃色固體則D為Na2O2,則:CO2的結構式為O=C=O,Na2O2的電子式為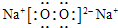 ;①如果A、B均由三種元素組成,B為兩性不溶物,結合轉化關系可知,A為偏鋁酸鈉、B為氫氧化鋁,偏鋁酸根與二氧化碳、水反應生成氫氧化鋁與碳酸根,反應離子方程式為:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,
;①如果A、B均由三種元素組成,B為兩性不溶物,結合轉化關系可知,A為偏鋁酸鈉、B為氫氧化鋁,偏鋁酸根與二氧化碳、水反應生成氫氧化鋁與碳酸根,反應離子方程式為:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,
②如果A由三種元素組成,B由四種元素組成,A、B溶液均顯堿性,結合轉化關系可知,A為碳酸鈉、B為碳酸氫鈉,溶液中碳酸根水解CO32-+H2O?HCO3-+OH-,破壞水的電離平衡,溶液呈堿性;常溫下,在該溶液中滴加稀鹽酸至中性時,氫離子與想與碳酸根轉化生成碳酸氫根,區別轉化碳酸氫根溶液,仍為堿性,故部分碳酸氫根轉化為碳酸,溶質的主要成分有NaCl、NaHCO3、H2CO3。
考點:位置結構性質的相互關系應用


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
I、鋁是地殼中含量最高的金屬元素,其單質及其合金在生產生活中的應用十分廣泛。
(1)金屬鋁的生產是以Al2O3為原料,與冰晶石(Na3AlF6)在熔融狀態下進行電解,則化學方程式為: .其電極均由石墨材料做成,則電解時不斷消耗的電極是 ;(填“陰極”或“陽極”)。
(2)對鋁制品進行抗腐蝕處理,可延長其使用壽命.以處理過的鋁材為陽極,在H2SO4溶液中電解,鋁材表面形成氧化膜,陽極反應式為 ;
(3)鋁電池性能優越,Al-Ag2O電池可用作水下動力電源,化學反應為2Al+3Ag2O+2NaOH+3H2O═2Na[Al(OH)4]+6Ag,則負極的電極反應式為 ,正極附近溶液的pH (填變大、不變或變小)。
II、氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用。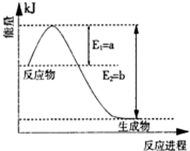
(1)圖是在一定溫度和壓強下N2和H2反應生成1molNH3過程中能量變化示意圖,請寫出合成氨的熱化學反應方程: (△H的數值用含字母a、b的代數式表示)。
(2)工業合成氨反應如下,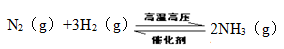
在一定溫度下,將一定量的N2和H2通入到體積為1L的密閉容器中,反應達到平衡后,改變下列條件,能使平衡向正反應方向移動且平衡常數不變的是 。
| A.增大壓強 | B.增大反應物的濃度 | C.使用催化劑 | D.降低溫度 |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
如下圖所示,將甲、乙兩個裝有不同物質的針筒用導管連接起來,將乙針筒內的物質緩緩地壓到甲針筒內,進行下表所列的不同實驗(氣體體積在常溫常壓下測定)。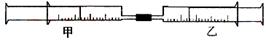
| 實驗序號 | 甲針筒內物質 | 乙針筒內物質 | 甲針筒的現象 |
| 1 | 40 mL HCl | 40 mLNH3 | 產生白煙 |
| 2 | 40 mL Cl2 | 10mL 水 | 剩余氣體為20mL |
| 3 | 30 mL NO | 15 mL O2 | |
| 4 | 20 mL AlCl3溶液 | 10 mL NaOH溶液 | 生成白色沉淀,后消失 |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
X、Y、Z、V、W是元素周期表前四周期中的五種常見元素,其相關信息如下表;
| 元素 | 相關信息 |
| X | X是形成化合物種類最多的元素,它的一種氣態氧化物能產生溫室效應 |
| Y | Y是地殼中含量最多的元素 |
| Z | Z和Y形成的一種化合物Z2Y2為淡黃色粉末,可作為呼吸面具里氧氣的來源 |
| V | V的單質是淡黃色固體,是黑火藥的一種主要成分 |
| W | W的單質是人們最早發現和使用的金屬之一 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(一)、某市對大氣進行監測,發現該市首要污染物為可吸入顆粒物PM2.5(直徑小于等于2.5um的懸浮顆粒物)其主要來源為燃煤、機動車尾氣等。因此,對PM2.5、SO2、NOx等進行研究具有重要意義。請回答下列問題:
(1)對PM2.5樣本用蒸餾水處理制成待測試樣。若測得該試樣所含水溶性無機離子的化學組分及其平均濃度如下表:
| 離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 濃度/mol.L | 4x10ˉ6 | 6x 10ˉ6 | 2x10ˉ5 | 4x10ˉ5 | 3x10ˉ5 | 2x10ˉ5 |
 H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)  H= -110.5KJ/mol
H= -110.5KJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 、
、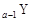 、
、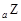 、
、 、
、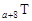 是五種常見的短周期元素,其原子半徑隨原子序數變化如下圖所示。Z是地殼中含量最高的元素。W原子最外層電子數是K層電子數的2倍。
是五種常見的短周期元素,其原子半徑隨原子序數變化如下圖所示。Z是地殼中含量最高的元素。W原子最外層電子數是K層電子數的2倍。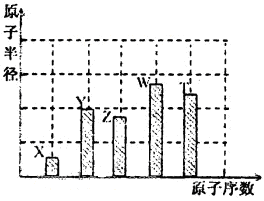
(l)W在周期表中的位置為_______________________。
(2)Y、Z的10電子氫化物分子中均含有的化學鍵類型為___________;其穩定性較強的是___________
(填化學式)。
(3)用化學方程式表示YZ2形成酸雨的反應:______________________。
用精密pH試紙(精確到0.l)測定酸雨pH的操作是______________________。
(4)常溫下用1 mol/L100 mL NaOH溶液恰好完全吸收0.1molTZ2氣體,此反應的離子方程式為
______________________;此時溶液pH<7的原因是___________________________。
(5)在25℃、101kPa下,己知W與X形成的氣態化合物與足量Z2點燃完全反應(生成W的最高價
化合物),恢復至原狀態,平均每轉移l mol e_放熱190 kJ,該反應的熱化學方程式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
周期表中短周期6種元素A、B、C、D、E、F,原子序數依次增大。A的原子半徑最小,A和D、C和F分別同主族,F的單質是黃色固體,B所形成的化合物種類最多,E的最外層電子數等于其電子層數。
(1)寫出工業制備E單質的化學方程式____________________。
(2)寫出一種由其中兩種元素組成的既含極性鍵又含非極性鍵的18電子微粒________(寫化學式)。
(3)由A、C元素組成的化合物甲與由D、C元素組成的化合物乙反應可制備O2,請寫出乙的電子式__________。
(4)3mol DABC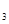 和2mol D
和2mol D C
C 混合,在密閉容器中加熱使之充分反應,然后趁熱排出氣體物質,容器內殘留物的成分及物質的量分別是____________________。
混合,在密閉容器中加熱使之充分反應,然后趁熱排出氣體物質,容器內殘留物的成分及物質的量分別是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
隨著鹵素原子半徑的增大,下列遞變規律正確的是
| A.單質的熔點逐漸降低 | B.鹵素離子還原性逐漸增強 |
| C.氣態氫化物穩定性逐漸增強 | D.單質氧化性逐漸增強 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
根據原子結構及元素周期律的知識,下列推斷正確的是
| A.同主族元素含氧酸的酸性隨核電荷數的增加而減弱 |
| B.核外電子排布相同的微粒化學性質也相同 |
| C.Cl?、S2?、Ca2+、K+半徑逐漸減小 |
D.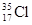 與 與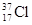 得電子能力相同 得電子能力相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com