
【題目】草酸鈷是制作氧化鈷和金屬鈷的原料。一種利用含鈷廢料(主要成分為Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有機物等)制取CoC2O4的工藝流程如圖:

(1)“550℃焙燒”的目的是_____________________________。
(2)“浸出液”的主要成分是__________________。
(3)“鈷浸出”過程中Co3+轉化為Co2+,該反應的離子方程式為_________________________。
(4)“凈化除雜1”過程中,先在40~50℃加入H2O2,再升溫至80~85℃,加入Na2CO3溶液,調pH至4.5,“濾渣1”主要成分的是__________________。
(5)“凈化除雜2”可將鈣、鎂離子轉化為沉淀過濾除去,若所得濾液中c(Ca2+)=1.0×l0-6mol/L,則濾液中c(Mg2+)為__________________。[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
(6)為測定制得樣品的純度,現稱取1.000g樣品,將其用適當試劑轉化,得到草酸銨溶液,再用過量稀硫酸酸化,用0.1000mol/LKMnO4溶液滴定,達到滴定終點時,共用去KMnO4溶液24.00mL,則草酸鈷樣品的純度為___________。
(7)取一定質量的CoC2O4·2H2O分解后的鈷氧化物(Co的化合價為+2、+3),用480ml 5mol/L鹽酸恰好完全溶解固體,得到CoCl2溶液和4.48L(標準狀況)黃綠色氣體。試確定該鈷氧化物中Co、O的物質的量之比為___________。
【答案】除去碳和有機物 NaAlO2 2Co3++SO32-+H2O=2Co2++SO42-+2H+ Fe(OH)3 7.0×10-7mol/L 88.2% 5:6
【解析】
(1)“550℃焙燒”的目的,應從含鈷廢料中含有碳和有機物進行分析;
(2)“浸出液”的主要成分,應為含鈷廢料中的某物質與堿反應的產物;
(3)“鈷浸出”過程中Co3+轉化為Co2+,則發生Co3+與SO32-反應,生成SO42-、Co2+等;
(4)“凈化除雜1”過程中,先在40~50℃加入H2O2,再升溫至80~85℃,加入Na2CO3溶液,調pH至4.5,“濾渣1”主要成分是Fe3+水解的產物;
(5)先利用Ksp(CaF2)=1.05×10-10,求出c2(F-),再由Ksp(MgF2)=7.35×10-11,求出c(Mg2+);
(6)利用電子守恒,建立關系式2MnO4-——5C2O42-——5CaC2O4,n(CaC2O4)=![]() n(MnO4-),從而求出草酸鈷樣品的純度;
n(MnO4-),從而求出草酸鈷樣品的純度;
(7)利用關系式O——2H+,Co2+——2Cl-,可分別求出Co、O原子的物質的量,從而求出該鈷氧化物中Co、O的物質的量之比。
(1)“550℃焙燒”的目的,是從含鈷廢料中除去碳和有機物;
答案為:除去碳和有機物;
(2)“浸出液”的主要成分,為含鈷廢料中Al2O2與NaOH反應的產物NaAlO2;
答案為:NaAlO2;
(3)“鈷浸出”過程中Co3+轉化為Co2+,則發生Co3+與SO32-反應,生成SO42-、Co2+等,離子方程式為2Co3++SO32-+H2O=2Co2++SO42-+2H+;
答案為:2Co3++SO32-+H2O=2Co2++SO42-+2H+;
(4)“凈化除雜1”過程中,先在40~50℃加入H2O2,再升溫至80~85℃,加入Na2CO3溶液,調pH至4.5,“濾渣1”主要成分是Fe3+水解的產物Fe(OH)3;
(5) Ksp(CaF2)=1.05×10-10,c2(F-)=![]() =1.05×10-5mol/L;Ksp(MgF2)=7.35×10-11,c(Mg2+)=
=1.05×10-5mol/L;Ksp(MgF2)=7.35×10-11,c(Mg2+)=![]() =7.0×10-7mol/L;
=7.0×10-7mol/L;
答案為:7.0×10-7mol/L;
(6)利用電子守恒,建立關系式2MnO4-——5C2O42-——5CaC2O4,n(CaC2O4)=![]() n(MnO4-)=
n(MnO4-)=![]() ×0.1000mol/L×0.024mL=0.006mol,從而求出草酸鈷樣品的純度
×0.1000mol/L×0.024mL=0.006mol,從而求出草酸鈷樣品的純度![]() = 88.2%;
= 88.2%;
答案為:88.2%;
(7)利用關系式O——2H+,Co2+——2Cl-,可求出n(Co)= ![]() (5mol/L×0.48L-
(5mol/L×0.48L-![]() )=1mol,n(O)=
)=1mol,n(O)=![]() ×5mol/L×0.48L=1.2mol,從而得出n(Co):n(O)=1mol:1.2mol=5:6;
×5mol/L×0.48L=1.2mol,從而得出n(Co):n(O)=1mol:1.2mol=5:6;
答案為:5:6。


科目:高中化學 來源: 題型:
【題目】依據下列甲、乙、丙三圖判斷,下列敘述不正確的是
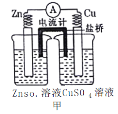
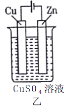
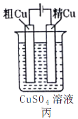
A.甲是原電池,乙是電鍍裝置
B.甲、乙裝置中,鋅極上均發生氧化反應
C.乙、丙裝置中,陽極均發生氧化反應而溶解
D.丙裝置中,若粗銅中含有Au、Ag、Fe、Zn等雜質,電解后Au、Ag形成陽極泥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】輝銅礦的主要成分是Cu2S,含較多的Fe2O3、SiO2雜質:軟錳礦的主要成分是MnO2,含有較多的SiO2雜質。輝銅礦的濕法冶煉,目前國內外都處于探索之中。自氧化還原氨分離法是一種較為理想的濕法冶煉方法,工藝流程如下:

回答下列問題:
(1)“浸出”時,為提高礦石的浸出率,下列措施可采取的是________。(填標號)
A 適當提高浸出溫度 B 適當延長浸出時間 C 增大礦石的粒度
(2)將100g輝銅礦和40g 98%的濃硫酸混合,在80~90℃條件下浸出2.5h,銅的浸出率隨軟錳礦用量的變化如下:
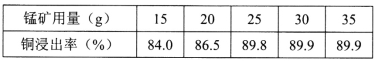
則浸出100g輝銅礦,軟錳礦的最適宜用量為_____g。
(3)“浸出”后的浸出液中含有CuSO4、MnSO4、Fe2(SO4)3等溶質,“濾渣I”中含有淡黃色固體單質,則“浸出”時產生淡黃色固體的化學方程式為__________________________。
(4)研究表明礦物中Fe2O3在“浸出”反應中起著重要的媒介作用,促進Cu2S與MnO2的溶解,其反應過程如下:
①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
②Cu2S+2Fe2(SO4)3=2CUSO4+4FeSO4+S↓;
③___________________________________。(寫出反應的化學方程式)
(5)“濾渣II”的主要成分是______________;“沉錳”后,得到的深藍色溶液中除NH4+、H+外,還含有的陽離子為__________。(寫化學式)
(6)“濾液III”經結晶可得到(NH4)2SO4晶體。結晶時,當________時,即可停止加熱。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,將儀器A中的濃鹽酸滴加到盛有MnO2的燒瓶中,加熱后產生的氣體依次通過裝置B和C,然后再通過加熱的石英玻璃管D(放置有鐵粉)。請回答下列問題:
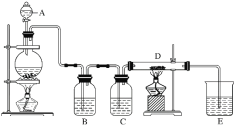
(1)儀器A的名稱是________,燒瓶中反應的化學方程式是___________。
(2)裝置B中盛放液體是_______,氣體通過裝置B的目的是___________。
裝置C中盛放的液體是________,氣體通過裝置C的目的是____________。
(3)D中反應的化學方程式是__________________。
(4)燒杯E中盛放的液體是________,反應的化學方程式是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示,X、Y、Q、W 都是惰性電極,將電源接通后,W極附近顏色逐漸加深。下列說法中不正確的是

A.電源的M 極為正極
B.甲裝置中溶液的pH 減小
C.甲裝置的兩個電極上都有單質生成且物質的量之比為1︰1
D.欲用乙裝置給銅鍍銀,U 極應該是Ag,電鍍液選擇AgNO3溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究發現,NOx和SO2是霧霾的主要成分。
Ⅰ.NOx主要來源于汽車尾氣,可以利用化學方法將二者轉化為無毒無害的物質。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+196 kJ·mol-1
2NO(g) ΔH=+196 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-554 kJ·mol-1
2CO2(g) ΔH=-554 kJ·mol-1
(1)請寫出NO和CO轉變為兩種無毒無害的物質的熱化學方程式_______________。
(2)T℃時,將等物質的量的NO和CO充入容積為2 L的密閉容器中,保持溫度和體積不變,反應過程(0~15 min)中NO物質的量隨時間變化如圖所示。
①已知:平衡時氣體的分壓=氣體的體積分數×體系的總壓強,T℃時達到平衡,此時體系的總壓強為p=30MPa,則T℃時該反應的壓力平衡常數Kp =_______;平衡后,若保持溫度不變,再向容器中充入NO和CO2各0.3mol,平衡將_____ (填“向左”、“向右”或“不”)移動。
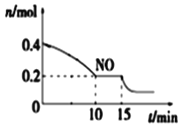
②15 min時,若改變外界反應條件,導致n(NO)發生如圖所示的變化,則改變的條件可能是_____(填序號)
A.升溫 B.增大CO濃度 C.加入催化劑 D.減小容器體積
(3)在373K時,向體積為2L的恒容真空容器中通入0.40molNO2,發生反應:2NO2(g)![]() N2O4(g) ΔH=57.0kJ·mol1。測得NO2的體積分數[φ(NO2)]與反應時間(t)的關系如下表:
N2O4(g) ΔH=57.0kJ·mol1。測得NO2的體積分數[φ(NO2)]與反應時間(t)的關系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20min內,v(N2O4)=_________________。
②上述反應中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2為速率常數,則373K時,k1、k2的數學關系式為__________。
(4)最新研究發現,用隔膜電解法可以處理高濃度乙醛廢水。原理:使用惰性電極電解,乙醛分別在陰、陽極轉化為乙醇和乙酸,總反應為2 CH3CHO+H2O![]() CH3CH2 OH+CH3COOH。實驗室中,以一定濃度的乙醛-Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置示意圖如圖所示
CH3CH2 OH+CH3COOH。實驗室中,以一定濃度的乙醛-Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置示意圖如圖所示
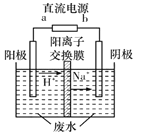
①電解過程中,兩極除分別生成乙酸和乙醇外,均產生無色氣體,陽極電極反應分別為4OH--4e-=O2↑+2H2O、__________________。
②在實際工藝處理過程中,陰極區乙醛的去除率可達60%。若在兩極區分別注入1m3乙醛的含量為300mg/L的廢水,可得到乙醇_______kg(計算結果保留2位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖中,甲是電解飽和食鹽水,乙是銅的電解精煉,丙是電鍍,回答:

(1)b極上的電極反應式為__,甲電池的總反應化學方程式是__。
(2)在粗銅的電解過程中,圖中c電極的材料是__(填“粗銅板”或“純銅板”);在d電極上發生的電極反應為__;若粗銅中還含有Au、Ag、Fe等雜質,則沉積在電解槽底部(陽極泥)的雜質是__,電解一段時間后,電解液中的金屬離子有__。
(3)如果要在鐵制品上鍍鎳(二價金屬,相對原子質量59),則f電極的材料是__(填“鐵制品”或“鎳塊”,下同),e電極的材料是__。
(4)若e電極的質量變化118 g,則a電極上產生的氣體在標準狀況下的體積為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】重鉻酸鉀是工業生產和實驗室的重要氧化劑,工業上常用鉻鐵礦(主要成分為FeO·Cr2O3,雜質為SiO2、Al2O3)為原料生產它,實驗室模擬工業法用鉻鐵礦制K2Cr2O7的主要工藝如圖。涉及的主要反應是:6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O

(1)堿浸前將鉻鐵礦粉碎的作用是_______________。
(2)步驟③調節pH后過濾得到的濾渣是____________。
(3)操作④中,酸化時,CrO42-轉化為Cr2O72-,寫出平衡轉化的離子方程式________。
(4)用簡要的文字說明操作⑤加入KC1的原因____________。
(5)稱取重鉻酸鉀試樣2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化鉀(鉻的還原產物為Cr3+),放于暗處5min。然后加入100mL水,加入3mL淀粉,用0.1200mol/LNa2S2O3標準溶液滴定(I2+2S2O32-=2I一十S4O52-)
①滴定時淀粉的作用為_______,判斷達到滴定終點的依據是_____________。
②若實驗中共用去Na2S2O3標準溶液40.00mL,則所得產品中重鉻酸鉀的純度為(設整個過程中其它雜質不參加反應)_____________(保留2位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,隔板I固定不動,活塞Ⅱ可自由移動,M、N兩個容器中均發生反應:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合氣體,初始M、N容積相同,保持溫度不變.下列說法正確的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合氣體,初始M、N容積相同,保持溫度不變.下列說法正確的是( )

A. 若x=3,達到平衡后A的體積分數關系為:φ(M)>φ(N)
B. 若x>3,達到平衡后B的轉化率關系為:α(M)>α(N)
C. 若x<3,C的平衡濃度關系為:c(M)>c(N)
D. x不論為何值,起始時向N容器中充入任意值的C,平衡后N容器中A的濃度均相等
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com