
(11分)由C、Cu、FeCO3、銅銹[主要成分為Cu2(OH)2CO3]組成的固體混合物,進行了如下所示的實驗過程: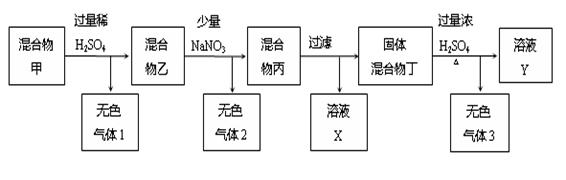
回答下列問題:
(1)無色氣體1的成分是: 。
(2)混合物乙中加入NaNO3后,寫出一個可能產生無色氣體2的反應的離子方程式:
(3)溶液X中含有的金屬陽離子是 。
(4)無色氣體3成分是 ,已知固體混合物丁的的質量為5.6g,在標準狀況下無色氣體3的體積為14.56L,求無色氣體3各成分的物質的量: 。(寫出具體的計算過程)
(1)CO2 (2分)
(2) 3Cu + 2NO3- + 8H+= 3Cu2+ + 2NO↑ + 4H2O 或
3Fe2+ + NO3- + 4H+= 3Fe3+ + NO↑ + 2H2O(2分)
(3)Cu2+、Fe2+、Na+(2分)(漏填或錯填1個扣1分)
(4)CO2 、SO2 (1分)CO2:0.2mol、SO2 :0.45mol(4分)(無具體的計算過程得2分)
解析試題分析:(1)稀硫酸與FeCO3、銅銹[主要成分為Cu2(OH)2CO3]反應生成二氧化碳氣體;(2)加入NaNO3后在酸性條件下,NO3-具有強氧化性,與還原性物質Cu和Fe2+反應生成NO氣體;因為加入少量NaNO3,故NO3-優先氧化還原性強的Cu,溶液中含有Cu2+、Fe2+、Na+;(4)固體混合物丁中一定含有碳,可能含有銅,如只含有碳,則5.6g碳可生成氣體5.6÷12×3×22.4=31.36L故固體應為碳和銅的混合物,反應方程式為C+2H2SO4=2SO2+CO2+2H2O Cu+2H2SO4=SO2+CuSO4+2H2O;根據方程式可得等式為12n(C)+64n(Cu)=5.6
3n(C)+ n(Cu)=14.56÷22.4[氣體物質的量]
解得CO2:0.2mol、SO2 :0.45mol
考點:考查元素化合物轉變與計算等有關問題。


科目:高中化學 來源: 題型:單選題
下列各組反應,最終一定能得到白色沉淀的是
| A.向Na2SiO3溶液中加入稀鹽酸 |
| B.向CuSO4溶液中加入NaOH溶液 |
| C.向FeCl3溶液中加入過量NaOH溶液 |
| D.向Al2(SO4)3溶液中加入過量NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知甲、乙、丙分別代表中學化學中的常見物質,請根據題目要求回答下列問題:
Ⅰ.若甲的化學式為RCl3,其溶液在加熱蒸干并灼燒時可發生反應:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
①若甲為某用途廣泛的金屬元素的氯化物,其溶液在上述變化中生成的氧化物為紅棕色粉末,則甲發生a反應的化學方程式為:
②若甲為某短周期金屬元素的氯化物,則該金屬在周期表中的位置是: ;
若向30 mL 1 mol/L的甲的溶液中逐漸加入濃度為4 mol/L的NaOH溶液,若產生0.78 g白色沉淀,則加入的NaOH溶液的體積可能為 (選填編號).
| A.3 mL | B.7.5 mL | C.15 mL | D.27.5 mL |
 丙。則:
丙。則: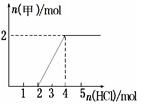
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Ⅰ:某些化學反應可表示為:A+B→C+D+H2O,請回答下列問題:
(1)若A、C、D均是鐵的化合物,B是稀硫酸,則A與B反應的化學方程式為
(2)若A、C、D均含有氯元素,且A中氯元素的化合價介于C與D之間,該反應離子方程式為 。
(3)若A為淡黃色固體,C為無色的氣體,則該反應的離子方程式為 。
Ⅱ:某些化學反應可表示為:A+NaOH+H2O→C+D。請回答下列問題:
(1)若A為金屬單質,C為非金屬單質,寫出符合要求的離子方程式_____________________
(2)若A為非金屬單質,C為非金屬單質,寫出符合要求的化學反應方程式
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
完成以下離子方程式或化學方程式:
(1)實驗室制備氯氣的離子方程式
(2)實驗室制備氫氧化鋁的離子方程式
(3)實驗室制備氨氣的化學方程式
(4)在實驗室制備Fe(OH)2的過程中,常會出現白色沉淀迅速變成灰綠色,緩慢變成紅褐色的現象。寫出這步變化的化學方程式
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
X、Y、Z、M、G五種元素分屬三個短周期,且原子序數依次增大。X、Z同主族,可形成離子化合物ZX ; Y、M同主族,可形成MY2、MY3兩種分子。
(1)Y在元素周期表中的位置為 。
(2)上述元素的最高價氧化物對應的水化物酸性最強的是 (寫化學式),非金屬氣態氫化物還原性最強的是 (寫化學式)。
(3)X、Y、Z、M組成兩種鹽的溶液反應可產生MY2氣體,寫出其反應離子方程式:
(4)M的氧化物與G的單質的水溶液均有漂白性,相同條件下,相同體積的M的氧化物與Y的單質混合通入品紅溶液,品紅溶液 (填褪色或不褪色),原因(用化學方程式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
黃銅礦(CuFeS2)是制取銅及其化合物的主要原料之一,還可以制備硫及鐵的化合物。
(1)冶煉銅的反應為8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合價為+2,反應中被還原的元素是 (填元素符號)。
(2)上述冶煉過程中產生大量SO2。下列處理方案合理的是 (填代號)。
a.高空排放 b.用于制備硫酸 c.用純堿溶液吸收制Na2SO3 d.用濃硫酸吸收
(3)利用黃銅礦冶煉銅產生的爐渣(含Fe2O3、FeO、SiO2、Al2O3)可制備Fe2O3。方法為
①用稀鹽酸浸取爐渣,過濾。
②濾液先氧化,再加入過量NaOH溶液,過濾,將沉淀洗滌、干燥、煅燒。
據以上信息回答下列問題:
a.除去Al3+的離子方程式是 。
b.選用提供的試劑,設計實驗驗證爐渣中含有FeO。
提供的試劑:稀鹽酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水。所選試劑為 。證明爐渣中含有FeO的實驗現象為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
甲、乙、丙、丁、X是由短周期元素組成的純凈物,其中X為單質。上述物質轉化關 系如下圖所示(某些產物略去)。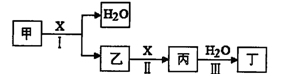
請回答下列問題:
(1)若丁是一元強酸,甲→丁是工業生產丁的主要途徑。
①寫出反應I的化學方程式: 。
②常溫下,1 mol丙發生反應III放出46kJ熱量,該反應的熱化學方程式為: 。
③在常溫下,向V1L pH= 11的甲溶液中加入V2L pH=3的鹽酸,若反應后溶液的pH<7,則V1和V2的關系為V1 V2(選填“>”、“<”或“=”),所得溶液中各種離子的濃度由大到小的順序可能是: (寫一種即可)。
(2)若丁是二元弱酸,丙是溫室氣體。
在容積為2L的容積固定的密閉容器中,將乙(g)和H2O(g)按下表用量分別進行反應:乙(g)+H2O(g)  丙(g) + H2(g),得到如下數據:
丙(g) + H2(g),得到如下數據: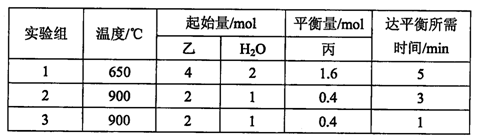
①該反應的正反應為 (填“吸熱”或“放熱”)反應。
②900℃時,上述反應按如下起始量分別加入該容器:
則此時反應的v(正) v(逆)(填“>”、“<”或“=”)。
③實驗3跟實驗2相比,改變的條件可能是 。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列結論正確的是 ( )
①粒子半徑:K>Cl>S ②氫化物穩定性:HF>H2S>PH3;
③離子還原性:S2->Cl->Br->I- ④單質氧化性:Cl2>S>Si;
⑤酸性:H2SO4>HClO ⑥堿性強弱:KOH>NaOH>Mg(OH)2
| A.①④⑤ | B.③⑥ | C.②④⑤⑥ | D.①③④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com