
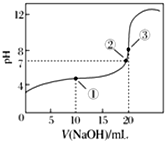
 常溫下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲線如圖所示.下列說法正確的是( )
常溫下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲線如圖所示.下列說法正確的是( )| A. | 點①所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| B. | 點②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | 點③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定過程中可能出現:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
分析 A.根據點①反應后溶液是CH3COONa與CH3COOH物質的量之比為1:1的混合物,結合物料守恒分析;
B.點②pH=7,即c(H+)=c(OH-),NaOH與醋酸恰好反應生成醋酸鈉顯堿性;
C.點③體積相同,則恰好完全反應生成CH3COONa,溶液顯堿性,醋酸根離子水解濃度減小;
D.剛開始滴定時,NaOH很少,溶液中主要是CH3COOH,CH3COOH發生部分電離,顯酸性.
解答 解:A、根據點①反應后溶液是CH3COONa與CH3COOH物質的量之比為1:1的混合物,所以c(CH3COO-)+c(CH3COOH)=2c(Na+),故A錯誤;
B、點②pH=7,即c(H+)=c(OH-),NaOH與醋酸恰好反應生成醋酸鈉顯堿性,顯中性,說明醋酸過量,所以c(Na+)<c(CH3COOH)+c(CH3COO-),故B錯誤;
C、點③說明兩溶液恰好完全反應生成CH3COONa,溶液顯堿性,醋酸根離子水解濃度減小,但是醋酸根離子的水解程度較小,則溶液中氫氧根離子濃度較小,故c(OH-)<<c(CH3COO-),正確的濃度大小為:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C錯誤;
D、剛開始滴定時,NaOH很少,溶液中主要是CH3COOH,CH3COOH發生部分電離,顯酸性,所以溶液中離子濃度為c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D正確;
故選D.
點評 本題考查離子濃度大小比較,題目難度中等,明確混合后溶液中的溶質組成為解答關鍵,注意電荷守恒和物料守恒的應用,試題培養了學生的靈活應用能力.


科目:高中化學 來源: 題型:選擇題
| A. | 二氧化碳和甲烷均是造成溫室效應的氣體 | |
| B. | 可借助于核磁共振氫譜區分乙醇和二甲醚這兩種物質 | |
| C. | 漂白液的有效成分是NaClO,制作計算機芯片的材料是SiO2晶體 | |
| D. | 食醋可去除水垢,NH4Cl溶液可去除鐵銹 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
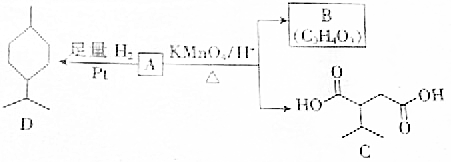
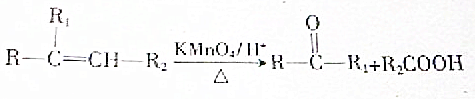
 .A與等物質量的溴單質反應的產物有3種.
.A與等物質量的溴單質反應的產物有3種.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:9 | B. | 9:1 | C. | 10:1 | D. | 1:10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陰極:NaOH溶液質量分數 | 陽極:NaCl溶液濃度(g/L) | |
| 進料液 | 0.30 | 310 |
| 電解后 | 0.32 | 210 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 學生用0.1mol/L KOH溶液滴定未知濃度的鹽酸溶液,其操作可分解為如下幾步:
學生用0.1mol/L KOH溶液滴定未知濃度的鹽酸溶液,其操作可分解為如下幾步:| 滴定次數 | 待測溶液的體積/mL | 標準溶液的體積/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com