
| A. | 已知常溫下0.1mol•L-1NaHA溶液的pH=9,則:c(Na+)═c(A2-)+c(HA-)+c(H2A) | |
| B. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH${\;}_{4}^{+}$)=c(K+)=c(Ba2+) | |
| C. | 25℃,pH=12的氨水和pH=2的鹽酸等體積混合:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| D. | 向AgNO3溶液中先滴加NaCl溶液至不再有沉淀生成,繼續滴加Na2S溶液,觀察到白色沉淀轉化為黑色,則溶解度大小關系為:Ag2S>AgCl |
分析 A.根據0.1mol•L-1NaHA溶液中的物料守恒判斷;
B.相同溫度下堿溶液的pH相同,則溶液中氫離子、氫氧根離子濃度也相同,根據三種溶液中的電荷守恒判斷;
C.一水合氨為弱堿,混合液中氨水過量,溶液顯示堿性,則c(OH-)>c(H+);
D.溶解度越大,難溶物越難溶,據此進行判斷二者溶解度大小.
解答 解:A.0.1mol•L-1NaHA溶液的pH=9,根據溶液中的物料守恒可得:c(Na+)=c(A2-)+c(HA-)+c(H2A),故A正確;
B.等pH的氨水、KOH溶液、Ba(OH)2溶液中的c(OH-)、c(H+)濃度也相同,根據電荷守恒可得:c(NH4+)=c(K+)=2c(Ba2+)=c(OH-)-c(H+),故B錯誤;
C.25℃,pH=12的氨水和pH=2的鹽酸等體積混合,一水合氨為弱堿,則混合液中氨水過量,混合液呈堿性,則c(OH-)>c(H+),結合電荷守恒可得:c(NH4+)>c(Cl-),溶液中正確的離子濃度大小為:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C錯誤;
D.向AgNO3溶液中先滴加NaCl溶液至不再有沉淀生成,繼續滴加Na2S溶液,觀察到白色沉淀轉化為黑色,說明硫化銀更難溶,則溶解度大小關系為:Ag2S<AgCl,故D錯誤;
故選A.
點評 本題考查了離子濃度大小比較、難溶物溶解度大小判斷,題目難度中等,注意掌握電荷守恒、物料守恒及鹽的水解原理在判斷離子濃度大小的應用方法,試題培養了學生靈活應用基礎知識的能力.


 開心快樂假期作業暑假作業西安出版社系列答案
開心快樂假期作業暑假作業西安出版社系列答案 名題訓練系列答案
名題訓練系列答案 期末集結號系列答案
期末集結號系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應中KNO3是氧化劑,N2是還原產物 | |
| B. | 每生成16 mol N2轉移30 mol電子 | |
| C. | 若氧化產物比還原產物多1.75mol,則轉移電子的物質的量為1.25mol | |
| D. | 該反應中氧化產物與還原產物的質量之比為1:15 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
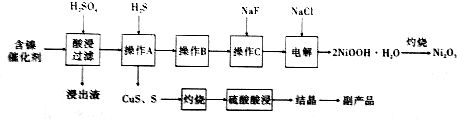
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
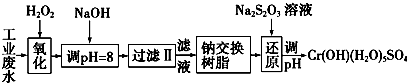
| 氫氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com