
【題目】CO2的利用是國際社會(huì)普遍關(guān)注的問題。
(1)CO2的電子式是______。
(2)CO2在催化劑作用下可以直接轉(zhuǎn)化為乙二醇和甲醇,但若反應(yīng)溫度過高,乙二醇會(huì)深度加氫生成乙醇。
![]()
獲取乙二醇的反應(yīng)歷程可分為如下2步:
Ⅰ.
Ⅱ.EC加氫生成乙二醇與甲醇
![]()
① 步驟Ⅱ的熱化學(xué)方程式是______。
② 研究反應(yīng)溫度對(duì)EC加氫的影響(反應(yīng)時(shí)間均為4小時(shí)),實(shí)驗(yàn)數(shù)據(jù)見下表:
反應(yīng)溫度/ ℃ | EC轉(zhuǎn)化率/ % | 產(chǎn)率/ % | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,溫度越高,EC的轉(zhuǎn)化率越高,原因是______。溫度升高到220 ℃時(shí),乙二醇的產(chǎn)率反而降低,原因是______。
(3)用稀硫酸作電解質(zhì)溶液,電解CO2可制取甲醇,裝置如下圖所示,電極a接電源的______極(填“正”或“負(fù)”),生成甲醇的電極反應(yīng)式是______。

(4)CO2較穩(wěn)定、能量低。為實(shí)現(xiàn)CO2的化學(xué)利用,下列研究方向合理的是______(填序號(hào))。
a.選擇高能量的反應(yīng)物和CO2反應(yīng)獲得低能量的生成物
b.利用電能、光能或熱能活化CO2分子
c.選擇高效的催化劑
【答案】 ![]()
 溫度越高,反應(yīng)速率越快 反應(yīng)溫度過高,乙二醇會(huì)深度加氫生成乙醇,乙二醇的產(chǎn)率降低 負(fù) CO2 + 6H+ + 6e == CH3OH + H2O abc
溫度越高,反應(yīng)速率越快 反應(yīng)溫度過高,乙二醇會(huì)深度加氫生成乙醇,乙二醇的產(chǎn)率降低 負(fù) CO2 + 6H+ + 6e == CH3OH + H2O abc
【解析】(1)①CO2為共價(jià)化合物,碳氧之間形成2條共價(jià)鍵,CO2的電子式是![]() ;正確答案:
;正確答案:![]() 。
。
(2)根據(jù)蓋斯定律可知:反應(yīng)Ⅱ-反應(yīng)Ⅰ,可得步驟Ⅱ的熱化學(xué)方程式是 ;正確答案:
;正確答案: 。
。
②由上表可知,溫度越高,反應(yīng)速率越快;EC的轉(zhuǎn)化率越高;當(dāng)溫度升高到220 ℃時(shí),乙二醇會(huì)深度加氫生成乙醇,乙二醇的產(chǎn)率降低;正確答案:溫度越高,反應(yīng)速率越快;反應(yīng)溫度過高,乙二醇會(huì)深度加氫生成乙醇,乙二醇的產(chǎn)率降低。
(3)CO2中碳+4價(jià),甲醇中碳為-2價(jià),電解CO2可制取甲醇,發(fā)生還原反應(yīng),所以電極a接電源的負(fù)極,生成甲醇的電極反應(yīng)式是CO2 + 6H+ + 6e == CH3OH + H2O; 正確答案:負(fù);CO2 + 6H+ + 6e == CH3OH + H2O。
(4)CO2較穩(wěn)定、能量低,為實(shí)現(xiàn)CO2的化學(xué)利用,選擇高能量的反應(yīng)物和CO2反應(yīng)獲得低能量的生成物,有利于反應(yīng)的發(fā)生,a正確;利用電能、光能或熱能活化CO2分子,增加二氧化碳活化分子百分?jǐn)?shù),加快反應(yīng)速率,b正確;選擇高效的催化劑,加快反應(yīng)速率,提高效率,c正確;正確選項(xiàng)abc。



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:
【題目】Ⅰ.科學(xué)家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應(yīng)生成甲醇,并開發(fā)出直接以甲醇為燃料的燃料電池。己知H2(g)、CO(g)和CH3OH(l)的燃燒熱ΔH分別為-285.8kJ·mol-1、-283.0 kJ·mol-1 和-726.5 kJ·mol-1。請(qǐng)回答下列問題:
(1)用太陽能分解10mol水消耗的能量是______________kJ。
(2)甲醇不完全燃燒生成一氧化碳和液態(tài)水的熱化學(xué)方程式為______________________________。
(3)在容積為2L的密閉容器中,由CO2和H2合成甲醇,保持其他條件不變,探究溫度對(duì)反應(yīng)的影響,實(shí)驗(yàn)結(jié)果如下圖所示(T1、T2均大于300℃)。下列說法正確的是________________(填序號(hào))
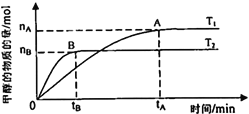
①溫度為T1時(shí),從反應(yīng)開始到平衡,生成甲醇的平均速率為v(CH3OH) =![]() mol·L-1·min-1
mol·L-1·min-1
②該反應(yīng)在T1時(shí)的平衡常數(shù)比T2時(shí)的小
③該反應(yīng)為放熱反應(yīng)
④處于A點(diǎn)的反應(yīng)體系從T1變到T2,達(dá)到平衡時(shí)![]() 增大
增大
(4)在T1溫度時(shí),將1mol CO2和3mol H2充入一密閉恒容容器中,充分反應(yīng)達(dá)到平衡后,若CO2轉(zhuǎn)化率為a,則容器內(nèi)的壓強(qiáng)與起始?jí)簭?qiáng)之比為______________。
Ⅱ.將廢水中的有害物質(zhì)轉(zhuǎn)變?yōu)闊o毒物質(zhì)、難溶物質(zhì)及易除去的物質(zhì),是廢水處理中的重要方法。
(5)含氰廢水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工業(yè)上有多種廢水處理方法。其中電解處理法如圖:用如圖所示裝置處理含CN-廢水時(shí),控制溶液pH為9~10并加入一定量的NaCl,一定條件下電解,陽極產(chǎn)生ClO-的將CN-氧化為無害物質(zhì)而除去。鐵電極為_____________(填“陰極”或“陽極”),陽極產(chǎn)生的ClO-的電極反應(yīng)為_______________________,陽極產(chǎn)生的ClO-的將CN-氧化為無害物質(zhì)而除去的離子方程式為___________________________。

查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】(12分)白炭黑(SiO2·H2O)廣泛用于橡膠、涂料、印刷等行業(yè),可用蛇紋石[主要成分為Mg6(Si4O10)(OH)8]來制取,其主要工藝流程如下:

(1)蛇紋石用氧化物形式可表示為____________。
(2)堿浸時(shí),為提高其中硅酸鹽的浸取率,除采用合適的液固比和循環(huán)浸取外,還可采用的方法有①_____________________;②_____________(任舉兩種)。
(3)過濾1得到的濾液的主要成分是______________________________。
(4)沉淀時(shí)加入氯化鈉溶液的作用可能是__________________________。
(5)洗滌時(shí),如何證明產(chǎn)品已洗滌干凈?_______________________________。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】室溫下,下列溶液等體積混合后,所得溶液的pH一定大于7的是
A.0.1mol/L的鹽酸和0.1mol/L的氫氧化鈉溶液
B.0.1mol/L的硫酸和0.1mol/L的氫氧化鋇溶液
C.pH=4的醋酸溶液和pH=10的氫氧化鈉溶液
D.pH=4的鹽酸和pH=10的氨水
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】運(yùn)動(dòng)會(huì)上發(fā)令槍所用“火藥”的主要成分是氯酸鉀和紅磷,撞擊時(shí)發(fā)生的化學(xué)反應(yīng)為:5KClO3+6P=3P2O5+5A(已配平)。
(1)生成物A的化學(xué)式是_____。
(2)該反應(yīng)是否是氧化還原反應(yīng)?_____(填“是”或“不是”)。若是,請(qǐng)指出被還原的元素;若不是,請(qǐng)說明理由:_________。
(3)已知銅在加熱時(shí)能被濃硫酸溶解,其反應(yīng)的化學(xué)方程式如下:Cu+2H2SO4(濃)=CuSO4+SO2↑+2H2O,用雙線橋法表示電子得失的方向和數(shù)目:____________。
(4)若2molCu參加反應(yīng),則該過程轉(zhuǎn)移的電子是___________mol。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】下列物質(zhì)都是常見的食品添加劑,其中使用時(shí)必須嚴(yán)格控制用量的是( )。
A.料酒B.食醋C.蔗糖D.亞硝酸鈉
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】下列說法中正確的是
A. 飽和石灰水中加入一定量生石灰,溶液溫度明顯升高,pH增大
B. AgCl懸濁液中存在平衡:AgCl(s) ![]() Ag+(aq)+Cl- (aq),往其中加入少量NaCl粉末,平衡向左移動(dòng),溶液中離子的總濃度減小
Ag+(aq)+Cl- (aq),往其中加入少量NaCl粉末,平衡向左移動(dòng),溶液中離子的總濃度減小
C. AgCl懸濁液中加入KI溶液,白色沉淀變?yōu)辄S色,證明此條件下Ksp(AgCl)>Ksp(AgI)
D. Na2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】軟錳礦的主要成分是MnO2,還含有少量(Hg2+等)重金屬化合物雜質(zhì)。黃鐵礦的主要成分是FeS2,還含有SiO2和Al2O3等雜質(zhì)。工業(yè)上采用同槽硫酸酸溶等工藝制備碳酸錳并回收硫酸銨,其主要流程如下:( 已知: Ksp[Al(OH) 3]=1 3×10-33,Ksp[Fe(OH) 3]=5.3×10-38,金屬離子的濃度小于1×10-6視為沉淀完全。)

(1)為了提高錳元素的浸出率,在“浸取”時(shí)可采取的措施有:
①適當(dāng)升高溫度,②攪拌,③_________________等。
(2)流程“氧化”中加入MnO2與Fe2+發(fā)生反應(yīng)的離子方程式為_________________。
(3)“濾渣2”中主要成分的化學(xué)式為_________________。
(4)流程“除重金屬”時(shí)使用(NH4)2S而不使用Na2S的原因是_________________。
(5)流程“50℃碳化”得到碳酸錳,該反應(yīng)的化學(xué)方程式為_________________。
(6)生成的碳酸錳產(chǎn)品需經(jīng)充分洗滌,檢驗(yàn)產(chǎn)品完全洗凈的方法是_________________。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】已知X、Y、Z都是金屬,若把X浸入Z的硝酸鹽溶液中,X的表面有Z析出;若X、Y和鹽酸形成原電池,Y為電池的負(fù)極。則X、Y、Z的金屬活動(dòng)性順序?yàn)椋?/span> )
A.Y>X>ZB.X>Z>YC.X>Y>ZD.Y>Z>X
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com