
【題目】2018年6月27日,國務院發布《打贏藍天保衛戰三年行動計劃》,該計劃是中國政府部署的一項污染防治行動計劃,旨在持續改善空氣質量,為群眾留住更多藍天。對廢氣的進行必要的處理,讓空氣更加清潔是環境科學的重要課題。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反應的平衡常數表達式為![]() ,請寫出此反應的熱化學方程式_________________。
,請寫出此反應的熱化學方程式_________________。
(2)用如圖所示的電解裝置可將霧霾中的NO、SO2分別轉化為NH![]() 和SO
和SO![]()
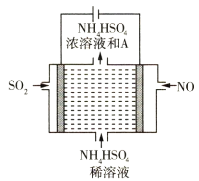
①寫出物質A的化學式____________。
②NO在電極上發生的反應為 _________________。
SO2在電極上發生的反應為 __________________。
(3)工業上常用氨水吸收SO2,可生成NH4HSO3和(NH4)2SO3。
①某同學測得氨水吸收SO2所得溶液中NH4HSO3和(NH4)2SO3的物質的量之比恰好為2:1,寫出該吸收過程的總反應方程式______________________________________。
②已知常溫下H2S的電離常數Ka1=1.3×10-7,Ka2=7.1×10-15,將等物質的量濃度的NaHS與Na2S溶液等體積混合,所得溶液中離子濃度大小順序為__________________。(用物質的量濃度符號由大到小排列)
【答案】2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H3=-746.5kJ/mol H2SO4 2NO+12H++10e-=2NH4++2H2O 5SO2+10H2O-10e-=5SO42-+20H+ 3SO2+4NH3·H2O=2NH4HSO3+(NH4)2SO3+H2O c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)
N2(g)+2CO2(g) △H3=-746.5kJ/mol H2SO4 2NO+12H++10e-=2NH4++2H2O 5SO2+10H2O-10e-=5SO42-+20H+ 3SO2+4NH3·H2O=2NH4HSO3+(NH4)2SO3+H2O c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)
【解析】
(1) 平衡常數表達式為![]() ,反應物為NO、CO,生成物為N2、CO2;根據蓋斯定律,求解即可;
,反應物為NO、CO,生成物為N2、CO2;根據蓋斯定律,求解即可;
(2)①SO2、NO分別變為銨根離子和硫酸根離子,則A為硫酸;
②NO在電極上失電子,變為銨根離子;SO2失電子,與水反應生成硫酸根離子和氫離子;
(3)①NH4HSO3和(NH4)2SO3的物質的量之比恰好為2:1,根據硫原子、氮原子守恒,則需要二氧化硫的系數為3,氨氣為4;
②根據電離平衡常數,求解NaHS的水解平衡常數,可確定NaHS的水解程度大于電離程度,而Na2S只水解生成HS-,即可判斷溶液中的離子濃度關系;
(1) 平衡常數表達式為![]() ,反應物為NO、CO,生成物為N2、CO2;①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol;②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol;③2C(s)+O2(g)=2CO(g) △H3=-221.0kJ/mol,根據蓋斯定律,2②-①-③可得2CO(g)+ 2NO(g)= N2(g)+CO2(g) △H=-746.5kJ/mol;
,反應物為NO、CO,生成物為N2、CO2;①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol;②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol;③2C(s)+O2(g)=2CO(g) △H3=-221.0kJ/mol,根據蓋斯定律,2②-①-③可得2CO(g)+ 2NO(g)= N2(g)+CO2(g) △H=-746.5kJ/mol;
(2)①SO2、NO分別變為銨根離子和硫酸根離子,則A為硫酸,其化學式為:H2SO4;
②NO在電極上失電子,變為銨根離子,發生的反應為2NO+12H++10e-=2NH4++2H2O;SO2失電子,與水反應生成硫酸根離子和氫離子,電極反應式為:5SO2+10H2O-10e-=5SO42-+20H+;
(3)①NH4HSO3和(NH4)2SO3的物質的量之比恰好為2:1,根據硫原子、氮原子守恒,則需要二氧化硫的系數為3,氨氣為4,則方程式為:3SO2+4NH3·H2O=2NH4HSO3+(NH4)2SO3+H2O;
②HS-的水解平衡常數Kw/ Ka1=![]() ,S2-的一級水解常數(一級水解遠遠大于二級水解)為Kw/ Ka2=
,S2-的一級水解常數(一級水解遠遠大于二級水解)為Kw/ Ka2=![]() ,顯然HS-的水解程度大于其電離程度,但是小于S2-的水解程度,而S2-只水解,且水解程度大于HS-的水解程度和電離程度,則溶液中的離子濃度為c(Na+)>c(HS-)>c(S2-);水解溶液呈堿性,且為少量水解,則c(S2-)>c(OH-)>c(H+),答案為:c(Na+)>c(HS-)>c(S2-)>c(OH/span>-)>c(H+)。
,顯然HS-的水解程度大于其電離程度,但是小于S2-的水解程度,而S2-只水解,且水解程度大于HS-的水解程度和電離程度,則溶液中的離子濃度為c(Na+)>c(HS-)>c(S2-);水解溶液呈堿性,且為少量水解,則c(S2-)>c(OH-)>c(H+),答案為:c(Na+)>c(HS-)>c(S2-)>c(OH/span>-)>c(H+)。


科目:高中化學 來源: 題型:
【題目】硝酸工業尾氣中氮的氧化物NO、NO2被氫氧化鈉溶液吸收的主要反應為:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO2+NO+2NaOH=2NaNO2+H2O,現有aL(標準狀況)NO和NO2混合氣體被足量氫氧化鈉溶液吸收,沒有氣體殘余,下列說法不正確的是 ( )
A.實際參加反應的氫氧化鈉的物質的量是a/22.4 mol
B.混合氣體氣體中NO2體積一定大于(等于)NO體積
C.溶液中NaNO3物質的量一定小于(等于)NaNO2物質的量
D.若生成的NaNO2與NaNO3的物質的量之比為3:1,則混合氣體中NO與NO2的體積比為3:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將足量的銅片與![]() 濃硫酸加熱充分反應,收集到標準狀況下的
濃硫酸加熱充分反應,收集到標準狀況下的![]() 氣體VL,下列對此反應的有關說法中錯誤的是
氣體VL,下列對此反應的有關說法中錯誤的是 ![]()
A. 該反應體現了濃硫酸的酸性和強氧化性
B. 反應結束后兩種反應物均有剩余
C. 被還原的硫酸為![]()
D. 參加反應的Cu為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化硼(BN)晶體有多種結構,六方相氮化硼是通常存在的穩定相,與石墨相似,具有層狀結構,有白色石墨之稱,具有電絕緣性,可作高溫潤滑劑。立方相氮化硼是超硬材料,硬度可媲美鉆石,常被用作磨料和刀具材料。它們的晶體結構如圖所示,關于兩種晶體的說法,錯誤的是
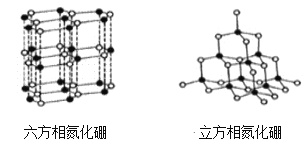
A. 六方相氮化硼屬于混合晶體,其層間是靠范德華力維系,所以質地軟
B. 立方相氮化硼含有σ鍵和π鍵,所以硬度大
C. 六方氮化硼不能導電是因為其層結構中沒有自由電子
D. 相同質量的六方相氮化硼和立方相氮化硼所含共價鍵數不相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知常溫下,3種物質的電離平衡常數如下表:
物質 | HCOOH | CH3COOH | NH3·H2O |
電離平衡常數K | 1.77×104 | 1.75×105 | 1.76×105 |
下列說法不正確的是
A.等物質的量濃度時,溶液pH:HCOONa<CH3COONa
B.pH均為3時,溶液濃度:c(HCOOH)>c(CH3COOH)
C.HCOOH溶液與氨水混合,當溶液pH=7時,c(HCOO-)=c(NH4+)
D.等物質的量濃度等體積的CH3COOH溶液和氨水混合,溶液pH約為7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組同學探究SO2與Fe3+鹽溶液的反應,進行了如下實驗:已知:Fe3++HSO3-Fe(HSO3)2+(紅棕色)
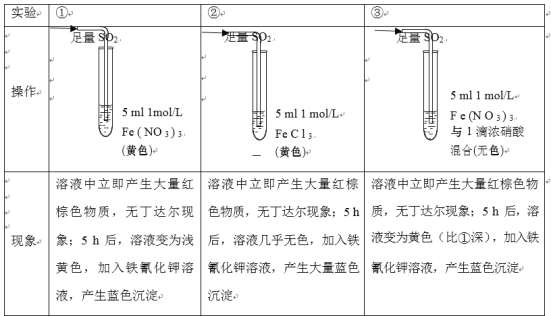
結合上述實驗,下列說法不正確的是
A.產生紅棕色物質的反應速率快于SO2與Fe3+氧化還原反應的速率
B.①與②對照,說明陰離子種類對SO2與Fe3+氧化還原反應的速率有影響
C.Fe(NO3)3溶液中加入1滴濃硝酸后變為無色,說明濃硝酸具有漂白性
D.5h后③比①黃色更深不能證明是NO3-濃度的增大減慢了SO2與Fe3+反應的速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物K是一種化工原料,其合成路線如下:
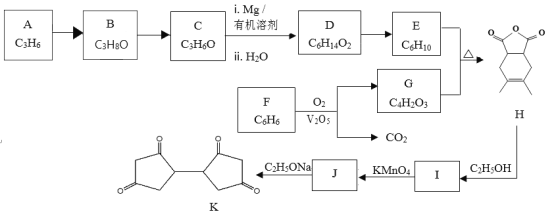
已知:i: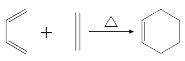
ii: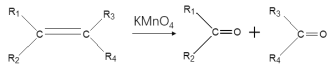
iii: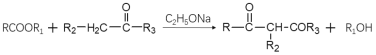 (R1為烴基)
(R1為烴基)
(1)按照官能團分類,A的類別是_______________________。
(2)C分子中只有一種類型的氫原子,B→C的化學方程式是_____________________。
(3)已知D的核磁共振氫譜有2個峰,1molD與足量Na反應可生成1molH2,寫出D→E的化學方程式是 ___________________________ 。
(4)G的結構簡式是___________________________。
(5)由F制備G,產物G與CO2物質的量之比為___________________________。
(6)M是G的同分異構體,寫出符合下列條件的M的結構簡式_________________。
a.能與NaHCO3反應產生氣泡
b.能發生銀鏡反應
(7)寫出結構簡式:I _____________、J _________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下,下列實驗用如圖所示裝置不能完成的是

A.測定一定質量的Cu和Mg混合物中Cu的含量
B.確定分子式為C2H6O的有機物分子中含活潑氫原子的個數
C.比較Fe3+和Cu2+對一定質量的雙氧水分解反應的催化效率
D.測定一定質量的Na2SO4·xH2O晶體中結晶水數目
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com