
【題目】碳及其化合物在有機合成、能源開發等方面具有十分廣泛的應用。
Ⅰ.工業生產精細化工產品乙二醛(OHC—CHO)
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,此反應的化學方程式為_____________,該法具有原料易得、反應條件溫和等優點,但也存在比較明顯的缺點: ___________________。
(2)乙二醇(HOCH2CH2OH)氣相氧化法
①已知:2H2(g)+O2(g) 2H2O(g) ΔH=-484 kJ/mol,化學平衡常數為K1。
OHC—CHO(g)+2H2(g) HOCH2CH2OH(g) ΔH=-78 kJ/mol,化學平衡常數為K2。
則乙二醇氣相氧化反應HOCH2CH2OH(g)+O2(g) OHC—CHO(g)+2H2O(g)的ΔH=______。相同溫度下,該反應的化學平衡常數K=_______(用含K1、K2的代數式表示)。
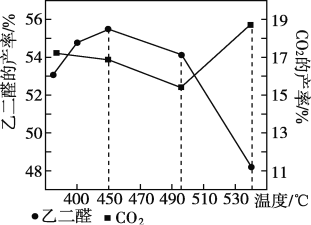
②當原料氣中氧醇比為4∶3時,乙二醛和副產物CO2的產率與反應溫度的關系如下圖所示。反應溫度在450~495 ℃之間和超過495℃時,乙二醛產率降低的主要原因分別是____________、___________。
Ⅱ.副產物CO2的再利用
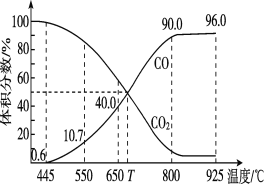
(3)一定量的CO2與足量的碳在體積可變的恒壓密閉容器中發生反應C(s)+CO2(g) 2CO(g),平衡時,體系中氣體體積分數與溫度的關系如下圖所示,則下列說法正確的是______(填字母)。
A.550℃時,若充入氫氣,則v正、v逆均減小,平衡不移動
B.650℃時,反應達平衡后CO2的轉化率為25%
C.T℃時,若再充入等物質的量的CO2和CO,平衡向逆反應方向移動
D.925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數Kp=24.0p總
已知:計算用平衡分壓代替平衡濃度,氣體分壓(p分)=氣體總壓(p總)×體積分數。
【答案】3CH3CHO+4HNO3![]() 3OHC—CHO+4NO↑+5H2O 生成的NO會污染空氣,硝酸會腐蝕設備 -406 kJ/mol
3OHC—CHO+4NO↑+5H2O 生成的NO會污染空氣,硝酸會腐蝕設備 -406 kJ/mol ![]() 升高溫度,主反應平衡逆向移動 溫度超過495 ℃時,乙二醇大量轉化為二氧化碳等副產物 B
升高溫度,主反應平衡逆向移動 溫度超過495 ℃時,乙二醇大量轉化為二氧化碳等副產物 B
【解析】
(1)催化劑是硝酸銅、反應物是乙醛和稀硝酸,生成物是乙二醛、NO和水,根據反應式和生成物書寫方程式;該反應中需要具有腐蝕性是酸,且生成有毒氣體NO;
(2)①OHC-CHO(g)+2H2(g)HOCH2CH2OH(g) △H=-78kJ/mol
2H2(g)+O2(g)2H2O(g) △H=-484kJ/mol
將兩個方程式相減得HOCH2CH2OH(g)+O2(g)OHC-CHO(g)+2H2O(g),△H進行相應的改變,方程式相減,平衡常數相除;
②從溫度對化學平衡移動的影響及溫度高發生副反應分析;
溫度升高,平衡向吸熱方向移動,溫度大于495℃二氧化碳產率增大;
(3)A.可變的恒壓密閉容器中反應,550℃時若充入與反應體系無關的氣體,相當于減小壓強,則v正,v逆均減小,又該反應是氣體體積增大的反應,平衡正向移動;
B.由圖可知,650℃時,反應達平衡后CO的體積分數為40%,設開始加入的二氧化碳為1mol,根據三段式進行計算;
C.由圖可知,T℃時,反應達平衡后CO和CO2的體積分數都為50%即為平衡狀態;
D.925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數Kp=![]() ,據此計算。
,據此計算。
(1)在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被還原為NO,反應方程式為:3CH3CHO+4HNO3![]() 3OHC—CHO+4NO↑+5H2O,該反應的反應物硝酸具有強烈的腐蝕性,而且反應生成物有NO,會造成空氣污染,因此該方法存在比較明顯的缺點是:生成的NO會污染空氣,硝酸會腐蝕設備;
3OHC—CHO+4NO↑+5H2O,該反應的反應物硝酸具有強烈的腐蝕性,而且反應生成物有NO,會造成空氣污染,因此該方法存在比較明顯的缺點是:生成的NO會污染空氣,硝酸會腐蝕設備;
(2)①a.OHC-CHO(g)+2H2(g)HOCH2CH2OH(g) △H=-78kJ/mol
b.2H2(g)+O2(g)2H2O(g) △H=-484kJ/mol
b-a,整理可得:減去第一個方程式得HOCH2CH2OH(g)+O2(g)OHC-CHO(g)+2H2O(g),△H=(-484kJ/mol)-(-78 kJ/mol)=—406kJ/mol,K1=![]() ;K2=
;K2=![]() ,
,![]() =
=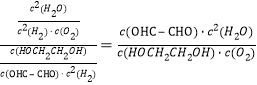 ,化學平衡常數K=
,化學平衡常數K=![]() ,所以K=
,所以K=![]() ;
;
②主反應HOCH2CH2OH(g)+O2(g)OHC-CHO(g)+2H2O(g) △H=—406kJ/mol為放熱反應,當反應達到平衡后,升高溫度平衡逆向移動,使乙二醛產率降低;而且當溫度超過495℃時,反應物乙二醇有大量發生副反應,轉化為CO2等副產物,也會使乙二醛產率降低;
(3)A.在可變的恒壓密閉容器中反應,550℃時若充入與反應體系無關的氣體如H2,相當于減小了壓強,由于反應混合物的濃度減小,所以v正,v逆均減小;又因為該反應的正反應是氣體體積增大的反應,所以減小壓強,化學平衡正向移動,A錯誤;
B.由圖可知,650℃時,反應達平衡后CO的體積分數為40%,設開始加入的二氧化碳為1mol,反應反應轉化了xmol,則有
C(s)+CO2(g) 2CO(g),
開始 1 0
轉化 x 2x
平衡 1-x
所以![]() ×100%=40%,解得x=0.25mol,所以CO2的轉化率為
×100%=40%,解得x=0.25mol,所以CO2的轉化率為![]() ×100%=25%,B正確;
×100%=25%,B正確;
C.由圖可知,T℃時,反應達平衡后CO和CO2的體積分數都為50%即為平衡狀態,若再加入等物質的量的CO、CO2,反應體系就是這兩種氣體,二者的含量不變,所以平衡不移動,C錯誤;
D.925℃時,CO的體積分數為96%,則CO2的體積分數都為4%,所以用平衡分壓代替平衡濃度表示的化學平衡常數Kp=![]() =
=![]() =23.0P,D錯誤;
=23.0P,D錯誤;
故合理選項是B。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. MnO2+ 4HCl(濃)![]() MnCl2 +Cl2↑ + 2H2O中,氧化劑和還原劑物質的量之比為1∶4
MnCl2 +Cl2↑ + 2H2O中,氧化劑和還原劑物質的量之比為1∶4
B. 2H2S+ SO2=3S+2H2O中,氧化產物和還原產物物質的量之比為1∶1
C. 3S+ 6KOH=2K2S+ K2SO3+3H2O中,被氧化和被還原的硫元素物質的量之比為2∶1
D. Al2O3+N2+3C![]() 2AlN+3CO中,氧化劑和還原劑物質的量之比為1∶3
2AlN+3CO中,氧化劑和還原劑物質的量之比為1∶3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的鹽酸,測得溶液中的HCO3-、CO32-、AlO2-、Al3+離子的物質的量與加入鹽酸溶液的體積變化關系如圖所示,則下列說法正確的是( )

A.原混合溶液中的CO32-與AlO2-的物質的量之比為1∶2
B.V1∶V2=1∶5
C.M點時生成的CO2為0.05 mol
D.e曲線表示的離子方程式為Al(OH)3+3H+===Al3++3H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】大地震過后,飲用水的消毒殺菌成為抑制大規模傳染性疾病爆發的有效方法之一,漂粉精是常用的消毒劑。
(1)工業上制取漂粉精的化學方程式為______________________,在使用漂粉精時,為了加速漂白作用,可以在漂粉精中加入少量________________.
(2)漂粉精暴露在空氣中易失效的主要原因是___________、_______________(用化學方程式表示)
(3)濃鹽酸和次氯酸鈣能發生如下反應Ca(ClO)2+4HCl(濃)=CaCl2+2Cl2↑+2H2O,用貯存很久的漂粉精和濃鹽酸反應制得的氯氣中,可能含有的雜質氣體是__________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)某有機物的結構表示為![]() ,其名稱是________________________。
,其名稱是________________________。
(2)寫出下列反應的化學方程式:
①草酸能使酸性高錳酸鉀溶液褪色:____________________________________。
②把濃硝酸、濃硫酸和甲苯混合加熱制備TNT:______________________________。
③溴乙烷在一定條件下發生消去反應:__________________________________。
(3)某烴A分子中碳的質量分數為90.57%,在某溫度下V L該烴的蒸氣質量是相同狀況下V L H2質量的53倍,則烴A的分子式為______________;若烴A分子中含有苯環,且苯環上的一氯代物只有一種,則A的結構簡式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
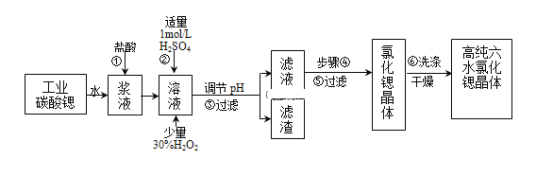
【題目】工業上用難溶于水的碳酸鍶(SrCO3)粉末為原料(含少量鋇和鐵的化合物)制備高純六水氯化鍶晶體(SrCl26H2O),其過程為:
已知:Ⅰ.有關氫氧化物沉淀的pH:
氫氧化物 | Fe(OH)3 | Fe(OH)2 |
開始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl26H2O晶體在61℃時開始失去結晶水,100℃時失去全部結晶水.
(1)操作①需要加快反應速率,措施有充分攪拌和______(寫一種).碳酸鍶與鹽酸反應的離子方程式______.
(2)在步驟②-③的過程中,將溶液的pH值由1調節至______;宜用的試劑為______.
A.1.5B.3.7C.9.7D.氨水E.氫氧化鍶粉末F.碳酸鈉晶體
(3)操作③中所得濾渣的主要成分是______(填化學式).
(4)工業上用熱風吹干六水氯化鍶,適宜的溫度是______
A.50~60℃B.80~100℃C.100℃以上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA代表阿伏加德羅常數的值,下列有關說法正確的是
A. 60g冰醋酸晶體中,含陰離子數目為NA
B. 標準狀況下,22.4LCCl4中含有分子的數目為NA
C. 常溫下,46gNO2與N2O4混合氣體中含分子數為NA
D. 32gCu投入300mL10mol/L的濃硝酸中,充分反應后轉移電子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的氫氣在氯氣中燃燒,所得混合物用100mL 3.00mol/L的NaOH溶液(密度為1.12g/mL)恰好完全吸收,測得溶液中含有NaClO的物質的量為0.0500mol。
(1)原NaOH溶液的質量分數為
(2)所得溶液中Cl-的物質的量為 mol
(3)所用氯氣和參加反應的氫氣的物質的量之比n(Cl2):n(H2)= 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化還原滴定實驗與酸堿中和滴定類似(用已知濃度的氧化劑溶液滴定未知濃度的還原劑溶液或反之)。測血鈣的含量時,進行如下實驗:
①可將2mL血液用蒸餾水稀釋后,向其中加入足量草酸銨(NH4)2C2O4晶體,反應生成 CaC2O4沉淀,將沉淀用稀硫酸處理得H2C2O4溶液。
②將①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化產物為CO2,還原產物為Mn2+。
③終點時用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)寫出用KMn04滴定H2C2O4的離子方程式_____________________。
(2)滴定時,將KMnO4溶液裝在________(填“酸式”或“堿式”)滴定管中。
(3)判斷滴定終點的方法是________________________。
(4)誤差分析:(填“偏高”、“偏低”或“無影響”)
①如果滴定管用蒸餾水洗后未用酸性KMnO4標準液潤洗,則測量結果________。
②滴定前后讀數都正確,但滴定前有氣泡,而滴定后氣泡消失,則測量結果________。
(5)計算:血液中含鈣離子的濃度為________mol/L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com