
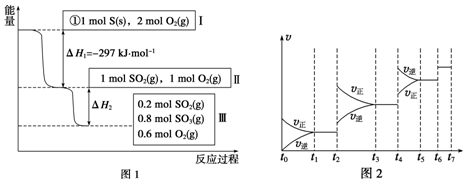
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
分析 (1)燃燒熱是指1mol可燃物完全燃燒生成穩定的氧化物放出的熱量;
(2)根據熱化學方程式:2SO2(g)+O2(g)=2SO3(g)△H=-196.6KJ•mol- 1計算;
(3)恒溫恒容時,開始為1molSO2和2molO2 與開始為1molSO2和1molO2 相比,開始為1molSO2和2molO2 的SO2轉化率高;
(4)反應最后得到硫酸鈉,根據鈉原子、硫原子原子守恒計算;
(5)恒溫恒容,甲與乙起始n(SO2):n(O2)=2:1,甲等效為在乙的基礎上增大一倍壓強,平衡向正反應移動,故甲中轉化率增大;丙按化學計量數轉化到左邊可得n(SO2)=2mol,n(O2)=1mol,與甲為等效平衡,平衡時對應各組分的物質的量相等,據此結合選項解答;
(6)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移動,t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移動,該反應為體積減小的放熱反應,若升高溫度,平衡逆向移動,若增大壓強,平衡正向移動,故t2~t3段為增大壓強,t4~t5段為升高溫度;
t2~t3段為增大壓強后,平衡正向移動,SO3的含量升高,至t3~t4平衡時含量達最高;
(7)根據K只與溫度有關,溫度增大,K減小.
解答 解:(1)燃燒熱是指1mol可燃物完全燃燒生成穩定的氧化物放出的熱量,所以,硫的物質的量為1mol.由圖1可知1molS(s)完全燃燒放出的熱量為297KJ,所以,硫的燃燒熱的熱化學方程式S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
故答案為:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
(2)由圖1可知,參加反應的n(SO2)=1mol-0.2mol=0.8mol,根據熱化學方程式:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ•mol- 1;可知,△H2=0.4△H=0.4×-196.6kJ•mol- 1=-78.64kJ•mol-1;
故答案為:-78.64kJ•mol-1;
(3)恒溫恒容時,開始為1molSO2和2molO2 與開始為1molSO2和1molO2 相比,增大氧氣的濃度,平衡正向移動,所以開始為1molSO2和2molO2 的SO2轉化率高,放出熱量的數值比|△H2|大.
故答案為:大;
(4)反應最后得到硫酸鈉,根據鈉原子、硫原子原子守恒,n(NaOH)=2n(S)=2×(0.2+0.8)mol=2mol.
若發生氧化還原反應,則是SO2被O2氧化,離子方程式為2SO2+O2+4OH-═2SO42-+2H2O.
故答案為:2mol;2SO2+O2+4OH-═2SO42-+2H2O;
(5)A、甲與丙為等效平衡,平衡時對應各組分的物質的量相等,故壓強P甲=P丙,甲等效為在乙的基礎上增大一倍壓強,平衡向正反應移動,故P乙<P甲<2P乙,故P甲=P丙<2P乙,故A錯誤;
B、甲與丙為等效平衡,平衡時對應各組分的物質的量相等,故質量m甲=m丙,乙等效為在甲到達平衡的基礎上,再減少1mol SO2和0.5mol O2,減小壓強,平衡向逆反應移動,SO2轉化率減小,則SO3的質量m甲>2m乙,故m甲=m丙>2m乙,故B正確;
C、對于甲、乙,SO2、O2起始物質的量之比等于化學計量數之比,c(SO2)與c(O2)之比為定值2:1,丙為分解反應,丙中c(SO2)與c(O2)之比為2:1,故k甲=k丙=k乙=2,故C錯誤;
D、甲與丙為等效平衡,平衡時對應各組分的物質的量相等,故Q甲+Q丙=197,甲等效為在乙的基礎上減小一半壓強,平衡向逆反應移動,SO2轉化率減小,故Q甲=197-Q丙>2Q乙,故D錯誤;
故選B;
(6)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移動;t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移動;該反應為體積減小的放熱反應,若升高溫度,平衡逆向移動,若增大壓強,平衡正向移動,所以t2~t3段為增大壓強,t4~t5段為升高溫度;t2~t3段為增大壓強后,平衡正向移動,SO3的含量升高,至t3~t4平衡時含量達最高;
故答案為:升高溫度;t3~t4;
(7)由(4)的分析可知t2~t3段為增大壓強,則K2=K1;t4~t5段為升高溫度,則K3<K2;所以K4=K3<K2=K1;
故答案為:K4=K3<K2=K1.
點評 本題考查了化學平衡移動與計算、反應熱知識、等效平衡等,難度較大,注意理解等效平衡等,關鍵在于讀圖獲取信息,培養學生分析問題解決問題能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
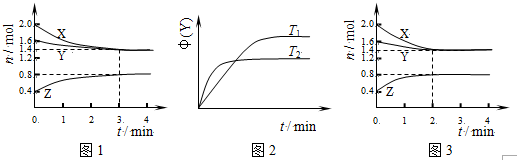
| A. | 容器中發生的反應可表示為:3X(g)+Y(g)?2Z(g) | |
| B. | 反應進行的前3min內,用X表示的反應速率v(X)=0.2mol•(L•min)-1 | |
| C. | 保持其他條件不變,升高溫度,反應的化學平衡常數K減小 | |
| D. | 其它條件不變,使用催化劑,則反應進程可能如圖3所示 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗序號 | 實驗方法 | 實驗現象 | 結論 |
| ① | 將氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 將氯水滴加到紫色石蕊試液中 | 氯水中不僅有H+還有HClO | |
| ③ | 將氯水滴加到淀粉-KI試紙上 | 淀粉-KI試紙變藍 (I2遇淀粉變藍) | 氯水中有Cl2 |
| ④ | 將足量的氯水滴加到NaHCO3溶液中 | 有氣泡生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分散系的分類: | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3膠體,可以加以區分 | |
| C. | 如圖顯示的是樹林的晨曦,該現象與丁達爾效應有關 | |
| D. | 在Fe(OH)3膠體中加入過量硫酸后會出現紅褐色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 單質--鋁 石墨 氮氣 | |
| B. | 混合物--空氣 粗鹽 牛奶 | |
| C. | 堿--燒堿 純堿 熟石灰 | |
| D. | 氧化物--氧化銅 二氧化錳 二氧化碳 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com