
| A. | 所含質子數和電子數相等的微粒一定是原子 | |
| B. | 兩種微粒如果核外電子排布相同,化學性質就一定相同 | |
| C. | 質量數相同的原子其化學性質一定相同 | |
| D. | 具有相同核電荷數的原子或單核離子一定是同種元素 |
分析 A、H2O、HF等均是10核微粒,質子數=電子數,不是原子;
B、核外電子排布相同,化學性質不一定相同;
C、化學性質與最外層電子排布有關,與質量數無關;
D、質子數決定元素的種類.
解答 解:A、H2O、HF、NH3等所含質子數和電子數均相等,但不是原子,故A錯誤;
B、Cl-只有還原性,K+只有氧化性,Ar既沒有氧化性也沒有還原性,但三者粒子核外電子排布相同,故B錯誤;
C、質量數相同的原子,其最外層電子數不一定相同,故化學性質不一定相同,故C錯誤;
D、元素是一類具有相同核電荷數原子的總稱,故具有相同核電荷數的原子或單核離子一定是同種元素,故D正確,
故選D.
點評 本題主要考查的是元素的組成,涉及質量數、化學性質決定因素、質子數等概念,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 稱取碳酸鈉晶體100g | |
| B. | 定容時俯視觀察刻度線 | |
| C. | 移液時,對用于溶解碳酸鈉晶體的燒杯沒有進行洗滌 | |
| D. | 定容后,將容量瓶振蕩均勻,靜置發現液面低于刻度線,于是又加入少量水至刻度線 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 用如圖實數裝置進行中加熱測定實驗,請回答下列問題:
用如圖實數裝置進行中加熱測定實驗,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 弱酸 | H2CO3 | 水楊酸(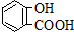 ) ) |
| 電離平衡常數(925℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常溫下,等濃度、等體積的NaHCO3溶液pH小于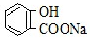 溶液pH 溶液pH | |
| B. | 常溫下,等濃度、等體積的Na2CO3溶液和  溶液中所含離子總數前者小于后者 溶液中所含離子總數前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→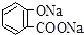 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水楊酸的第二級電離 Ka2 遠小于第一級電離Ka1的原因之一是能形成分子內氫鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | 相關信息 |
| X | X單質分子中σ鍵和π鍵數目之比為1:2 |
| Y | Y 基態原子的最外層電子排布式為 nsnnpn+2 |
| Z | Z的第一電離能在同周期主族元素中最小 |
| W | W的氧化物是導致酸雨的主要物質之一 |
| R | 基態原子的核外電子排布中未成對的電子數最多 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH3+H3PO4═NH4H2PO4 | B. | 2NH3+2Na═2NaNH2+H2 | ||
| C. | 8NH3+3Cl2═6NH4Cl+N2 | D. | 4NH3+5O2$\frac{\underline{\;催化劑\;}}{△}$4NO+6H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com