
【題目】某溫度下,在密閉容器中SO2、O2、SO3三種氣態物質建立化學平衡后,改變條件對反應2SO2(g)+O2(g)2SO3(g),△H<0的正、逆反應速率的影響如圖所示: 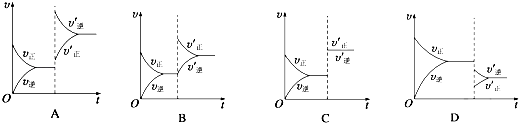
(1)加催化劑對反應速率影響的圖像是(填序號,下同),平衡移動.
(2)升高溫度對反應速率影響的圖像是 , 平衡向方向移動.
(3)增大反應容器體積對反應速率影響的圖像是 , 平衡向方向移動.
(4)增大O2的濃度對反應速率影響的圖像是 , 平衡向方向移動.
【答案】
(1)C;不
(2)A;逆反應
(3)D;逆反應
(4)B;正反應
【解析】解:(1)催化劑只影響反應速率,不影響化學平衡,所以加入催化劑后正逆反應速率同時增大且相等,化學平衡不發生移動,所以C正確; 故答案為:C;不;(2)升高溫度后,正反應速率和逆反應速率都增大,由于該反應為放熱反應,平衡向著逆反應方向移動,說明逆反應速率大于正反應速率,所以A正確,
故答案為:A;逆反應;(3)該反應為體積縮小的反應,增大反應容器體積,反應體系壓強減小,正逆反應速率都會減小,平衡向著體積增大的逆反應方向移動,說明逆反應速率減小幅度減小,即逆反應速率大于正反應速率,滿足該變化的圖像為D,
故答案為:D;逆反應;(4)增大O2的濃度的瞬間,逆反應速率不變,正反應速率增大,平衡向著正反應方向移動,滿足該變化的圖像為B,
故答案為:B;正反應.
(1)加入催化劑,正逆反應速率同時增大,且增大幅度相同,催化劑不影響化學平衡;(2)該反應為放熱反應,升高溫度,正逆反應速率都增大,由于平衡向著逆向移動,逆反應速率增大幅度大于正反應速率;(3)增大反應容器體積,減小了壓強,正逆反應速率都減小,平衡向著體積增大的逆反應方向移動;(4)增大反應物濃度的瞬間,正反應速率增大,逆反應速率不變,之后正反應速率逐漸減小,逆反應速率逐漸增大,直至達到新的平衡.


 目標測試系列答案
目標測試系列答案科目:高中化學 來源: 題型:
【題目】在一定溫度下,容器內某一反應中M、N的物質的量隨反應時間變化的曲線如圖,下列表述正確的是( ) 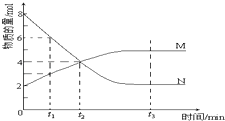
A.反應的化學方程式:N2M
B.t2時,正、逆反應速率相等,達到平衡
C.t2時,正反應速率大于逆反應速率
D.恒溫恒容下,當N的化學反應速率是M的兩倍時,則證明達到了化學平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于Cl、N、S等非金屬元素單質及其化合物的說法正確的是
A. 實驗室可用濃硫酸干燥氨氣
B. 陶瓷、水晶、水泥、玻璃都屬于硅酸鹽產品
C. 漂白粉變質后的殘留固體有碳酸鈣
D. 單質氯氣及單質硫與鐵反應生成的產物中,鐵的化合價相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,向容積為2L的密閉容器中通入兩種氣體發生化學反應,反應中各物質的物質的量變化如圖所示,對該反應的推斷合理的是

A.該反應的化學方程式為3B+2D 6A+4C
B.反應進行到1 s時,v(A)=3v(D)
C.反應進行到6 s時,B的平均反應速率為0.1mol/(Ls)
D.反應進行到6 s時,各物質的反應速率相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度(T℃)下的溶液中,c(H+)=10﹣x molL﹣1 , c(OH﹣)=10﹣y molL﹣1 , x與y的關系如圖所示,請回答下列問題: 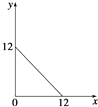
(1)此溫度下,水的離子積Kw為 , 則該溫度T25(填“>”、“<”或“=”).
(2)在此溫度下,向Ba(OH)2溶液中逐滴加入pH=a的鹽酸,測得混合溶液的部分pH如表所示.
實驗序號 | Ba(OH)2溶液的體積/mL | 鹽酸的體積/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假設溶液混合前后的體積變化忽略不計,則a= , 實驗②中由水電離產生的c(OH﹣)=molL﹣1.
(3)在此溫度下,將0.1molL﹣1的NaHSO4溶液與0.1molL﹣1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1molL﹣1 Ba(OH)2溶液體積/mL | 10 | 10 | 10 | 10 |
0.1molL﹣1 NaHSO4溶液體積/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液顯(填“酸”、“堿”或“中”)性.
②寫出按乙方式混合后,反應的離子方程式: .
③按甲方式混合后,所得溶液的pH為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】基態原子的核外電子排布為4d105s1的元素應在( )
A.s區、第五周期、ⅠA族B.ds區、第五周期、ⅠB族
C.d區、第四周期、ⅠB族D.ds區、第五周期、ⅠA族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋼鐵是目前應用最廣泛的金屬材料,了解鋼鐵腐蝕的原因與防護方法具有重要意義,對鋼鐵制品進行抗腐蝕處理,可適當延長其使用壽命。
(1)抗腐蝕處理前,生產中常用鹽酸來除鐵銹。現將一表面生銹的鐵件放入鹽酸中,當鐵銹除盡后,溶液中發生的化合反應的化學方程式為__________________。
(2)利用如圖裝置,可以模擬鐵的電化學防護。

①若X為碳棒,為減緩鐵件的腐蝕,開關K應置于________________處。
②若X為鋅,開關K置于M處,該電化學防護法稱為__________。
(3)圖中若X為粗銅,容器中海水替換為硫酸銅溶液,開關K置于N處,一段時間后,當鐵件質量增加3.2 g時,X電極溶解的銅的質量____3.2 g(填“<”“>”或“=”)。
(4)圖中若X為銅,容器中海水替換為FeCl3溶液,開關K置于M處,銅電極發生的反應是______________________,若將開關K置于N處,發生的總反應是_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】微生物電池是指在微生物的作用下將化學能轉化為電能的裝置,其工作原理如圖所示。下列有關微生物電池的說法錯誤的是 ( )

A. 正極反應中有CO2生成
B. 微生物促進了反應中電子的轉移
C. 質子通過交換膜從負極區移向正極區
D. 電池總反應為C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com