
分析 (1)發生的反應有:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+5H2O↑、CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑、4CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+O2↑ 等,假設產物全部是CuSO4,或者產物全部是CuO,計算固體質量判斷組成,再根據質量、Cu元素物質的量列方程計算;
(2)根據4CuO=2Cu2O+O2↑、2SO3  2SO2+O2↑判斷;
2SO2+O2↑判斷;
(3)最終固體產物為Cu2O,根據2CuSO4•5H2O~Cu2O計算;
(4)假設固體全部為Cu2O,計算其質量,結合(1)中計算判斷組成,再根據質量、Cu元素物質的量列方程計算.
解答 解:*(1)發生的反應有:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+5H2O↑、CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑、4CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+O2↑ 等,n(CuSO4•5H2O)=$\frac{25g}{250g/mol}$=0.1mol,
若產物全部是CuSO4,則m(CuSO4)=0.1mol×160g/mol=16g;
若產物全部是CuO,則m(CuO)=0.1mol×80g/mol=8g,
所以10g固體中含有CuSO4和CuO,設CuSO4和CuO分別為x、y,則:
x+y=0.1mol
160x+80y=10g
解得:x=0.025mol y=0.075mol
則:m(CuSO4)=0.025mol×160g/mol=4g m(CuO)=0.075mol×80g/mol=6g
答:固體產物質量是否可能為10g,其中CuSO4為4g、CuO為6g;
(2)根據反應:CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑,4CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+O2↑,
則有:n(SO3)=n(CuSO4)=0.1mol,n(O2)=$\frac{1}{4}$n(CuO)=$\frac{1}{4}$×0.1mol=0.025mol
則n(SO3)+n(O2)=0.1mol+0.025mol=0.125mol,
又:2SO3$\frac{\underline{催化劑}}{△}$2SO2+O2,若SO3完全分解,則氣體的物質的量最多為0.1mol×$\frac{3}{2}$+0.025mol=0.175mol,
所以氣體的物質的量準確的范圍是0.125<n<0.175,
故選:C;
(3)此反應條件下,最終固體產物為Cu2O,設質量為x,
2CuSO4•5H2O~Cu2O
2×250 144
25.0g x
解得x=7.2g,
答:終固體產物為7.2g,顏色為紅色;
(4)若產物全部是CuO,則質量為m(CuO)=0.1mol×80g/mol=8g;
若產物全部是Cu2O,則質量為m(Cu2O)=0.1mol×$\frac{1}{2}$×144g/mol=7.2g,
所以7.6g固體中含有Cu2O和CuO.
設Cu2O和CuO分別為amol、bmol,則:
2a+b=0.1mol
144a+80b=7.6g
解得:a=0.025mo b=0.05mol
即m(Cu2O)=0.025mol×144g/mol=3.6g m(CuO)=0.05mol×80g/mol=4g,
答:Cu2O為3.6g,CuO為4g.
點評 本題考查化學方程式的計算、混合物計算,題目難度較大,側重考查學生分析計算能力,注意根據物質的性質,結合反應的化學方程式計算.


 智趣寒假作業云南科技出版社系列答案
智趣寒假作業云南科技出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉著火時,用細沙覆蓋滅火,鎂著火用泡沫滅火器 | |
| B. | 用鹽酸標準溶液滴定待測的氫氧化鈉溶液時,水洗后的酸式滴定管未經標準液潤洗,則待測結果會偏低 | |
| C. | 測定一包白色粉末的質量,將藥品放在右盤,砝碼放在左盤 | |
| D. | 除去乙醇中的乙酸可先加入碳酸鈉溶液然后蒸餾 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
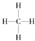 .一定量的該氣體燃燒過程的能量變化如圖1所示,從圖中可以讀出E1>E2(填“>”或“<”),該反應放出 (填“放出”或“吸收”)能量.
.一定量的該氣體燃燒過程的能量變化如圖1所示,從圖中可以讀出E1>E2(填“>”或“<”),該反應放出 (填“放出”或“吸收”)能量.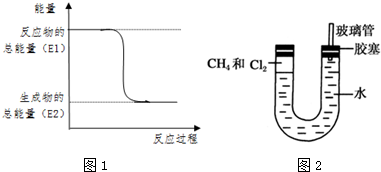
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S2-的結構示意圖: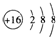 | B. | 中子數為10的氧原子:${\;}_{18}^{8}$O | ||
| C. | HClO的電子式: | D. | 硝基苯的結構簡式: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有①②③ | B. | 只有①②③⑤⑥ | C. | 只有①②③⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
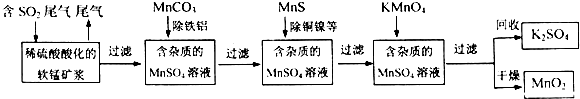
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
. $\stackrel{一定條件}{→}$
$\stackrel{一定條件}{→}$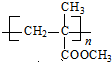 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
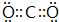 .
.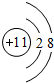 ,D、E結合形成的化合物的電子式
,D、E結合形成的化合物的電子式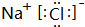 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com