
【題目】甲烷和丙烷混和氣的密度與同溫同壓下乙烷的密度相同,混和氣中甲烷和丙烷的體積比是( )
A. 2:1 B. 3:1 C. 1:3 D. 1:1
科目:高中化學 來源: 題型:
【題目】隨原子序數遞增,八種短周期元素(用字母x……表示)原子半徑的相對大小、最高正價或最低負價的變化如圖所示。
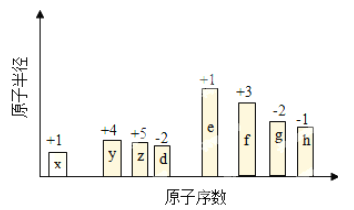
回答下列問題:
(1)H的離子結構示意圖為__________________________。
(2)由E和D兩元素形成的原子個數比為1∶1的化合物的電子式為______________。
(3)單質G易溶于YG2,則YG2的結構式為_______________。
(4)Z2X4是一種高效清潔的火箭燃料,8g該物質含有的共用電子對數目為_____________。
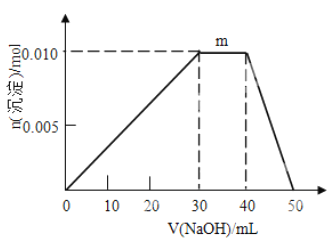
(5)上述元素可組成鹽R:ZX4F(GD4)2。向盛有10mL1mol·L-1R溶液的燒杯中滴加1mol·L-1NaOH溶液,沉淀物質的量隨NaOH溶液體積的變化如圖所示,則m點對應的離子方程式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】FeS與一定濃度的HNO3反應,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,當NO2、N2O4、NO的物質的量之比為1︰1︰1時,實際參加反應的FeS與HNO3的物質的量之比為( )
A. 1︰7 B. 1︰6 C. 2︰11 D. 16︰25
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是
A. H218O中投入Na2O2固體:2H218O+2Na2O2=4Na++4OH-+18O2↑
B. 用石墨作電極電解熔融態AlCl3制鋁:2Al3++6Cl-![]() 2Al +3Cl2↑
2Al +3Cl2↑
C. 在用硫酸酸化的KI溶液中滴入H2O2:2I-+ H2O2 = I2+ 2OH-
D. 將SO2通入溴水中:SO2 + Br2 + 2H2O = 4H++ 2Br-+SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中將2molNaHCO3(s)和一定量Na2O2混合,在加熱條件下讓其充分反應,150℃下所得氣體僅含2種組分,反應后固體的物質的量(n)的取值范圍是( )
A. n≥1 B. 1<n<2 C. 2≤n<4 D. n≥4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前流行的關于生命起源假設的理論認為,生命起源于約40億年前的古洋底的熱液環境。這種環境系統中普遍存在鐵硫簇結構,如Fe2S2、Fe4S4、Fe8S7等,這些鐵硫簇結構參與了生命起源的相關反應。某化學興趣小組在研究某鐵硫簇結構的組成時,設計了下列實驗。【實驗Ⅰ】硫的質量確定

按圖連接裝置,檢查好裝置的氣密性后,在硬質玻璃管A中放入1.00 g鐵硫簇結構(含有部分不反應的雜質),在試管B中加入50.00 mL 0.1000 molL-1的酸性KMnO4溶液,在試管C中加入品紅溶液。通入空氣并加熱,發現固體逐漸轉變為紅棕色。待固體完全轉化后將B中溶液轉移至250 mL容量瓶,洗滌試管B后定容。取25.00 mL該溶液用0.01000 molL-1的草酸(H2C2O4)進行測定剩余KMnO4溶液濃度的滴定。記錄數據如下:
滴定次數 | 待測溶液體積/mL | 草酸溶液體積/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.50 | 23.70 |
2 | 25.00 | 1.02 | 26.03 |
3 | 25.00 | 0.00 | 24.99 |
相關反應:① 2MnO4- + 2H2O + 5SO2![]() 2Mn2+ + 5SO42- + 4H+
2Mn2+ + 5SO42- + 4H+
② 2MnO4- + 6H+ + 5H2C2O4![]() 2Mn2+ +10CO2↑+ 8H2O
2Mn2+ +10CO2↑+ 8H2O
【實驗Ⅱ】鐵的質量確定
將實驗Ⅰ硬質玻璃管A中的殘留固體加入稀鹽酸中,充分攪拌后過濾,在濾液中加入足量的NaOH溶液,過濾后取濾渣,經充分灼燒得0.600 g固體。
試回答下列問題:
(1)檢查“實驗Ⅰ”中裝置氣密性的方法是_______________。
(2)滴定終點的判斷方法是______________。
(3)試管C中品紅溶液的作用是_______________;有同學提出,撤去C裝置,對實驗沒有影響,你的看法是___(選填“同意”或“不同意”),理由是________________。
(4)根據實驗Ⅰ和實驗Ⅱ中的數據可確定該鐵硫簇結構的化學式為___________________。
【問題探究】
滴定過程中,細心的小明發現該KMnO4顏色褪去的速率較平常滴定時要快得多。為研究快的原因,甲同學繼續進行了下列實驗,實驗數據如下表:
編號 | 溫度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色時間/s |
1 | 25 | 5.0 | 2.0 | 40 |
2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
3 | 60 | 5.0 | 2.0 | 25 |
(5)分析上述數據,滴定過程中反應速率較快的原因可能是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列遞變規律不正確的是( )
A.Na、Mg、Al的還原性依次減弱
B.I、Br、Cl的非金屬性性依次增強
C.C,N,O 的原子半徑依次增大
D.P,S,Cl的最高正化合價依次升高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將除去表面氧化膜的Al、Cu片插入濃HNO3中組成原電池(圖1),測得原電池的電流強度(I)隨時間(t)的變化如圖2所示,下列說法正確的是

A. 0-t1時,原電池的負極是銅片
B. 0-t1時,正極的電極反應式是2H++2e-=H2↑
C. t1時刻,電流方向發生變化的原因是Al 在濃硝酸中發生鈍化,氧化膜阻止了Al進一步反應
D. tl時刻后,電子從鋁經過導線流向銅
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com