
分析 (1)依據熱化學方程式和蓋斯定律計算構造所需熱化學方程式得到反應的焓變,由蓋斯定律:$\frac{1}{2}$×①+②得CO(g)+Na2O2(s)=Na2CO3(s);
(2)書寫時注意反應熱的數值應為1mol甲烷燃燒放出的熱量;
(3)根據甲硅烷的質量計算1mol甲硅烷燃燒放出的熱量,結合化學方程式書寫熱化學方程式.注意物質的聚集狀態和反應熱的單位等問題.
解答 解:(1)已知①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266kJ/mol,
由蓋斯定律:$\frac{1}{2}$×①+②得CO(g)+Na2O2(s)=Na2CO3(s)△H=$\frac{1}{2}$×(-566)+(-266)=-549 kJ/mol,
故答案為:CO(g)+Na2O2(s)=Na2CO3(s)△H=-549 kJ/mol;
(2)0.5mol CH4完全燃燒生成CO2和液態水時,放出445kJ熱量,所以1mol甲烷完全燃燒生成液態水時能放出890kJ的熱量,故甲烷燃燒生成液態水時的熱化學反應方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ•moL-1,故答案為:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ•moL-1;
(3)n(SiH4)=$\frac{3.2g}{32g/mol}$=0.1mol,則1molSiH4燃燒放出的熱量為:792kJ,
反應的化學方程式為:SiH4+O2=SiO2+2H2O,則熱化學方程式為:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=-792kJ/mol,
故答案為:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=-792kJ/mol.
點評 本題考查熱化學方程式的書寫,為高頻考點,把握物質的量與熱量的關系、熱化學方程式的書寫方法等為解答的關鍵,側重分析與計算能力的考查,注意放熱反應的焓變為負值,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 稱量時托盤上要墊上干凈的稱量紙 | |
| B. | 移液時不慎有部分液體濺出,會造成所配溶液濃度偏小 | |
| C. | 定容時俯視容量瓶刻度線,會造成所配溶液濃度偏大 | |
| D. | 定容搖勻后發現液面下降,不應再加蒸餾水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
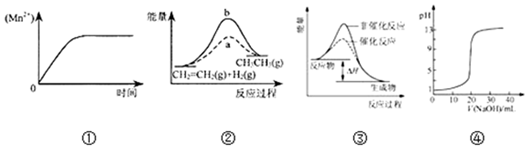
| A. | 圖①表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液與過量的0.1 mol•L-1 H2C2O4溶液混 合時,n(Mn2+) 隨時間的變化 | |
| B. | 圖②中a、b曲線分別表示反應CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化劑時,反應過程中的能量變化 | |
| C. | 圖③表示某放熱反應分別在有、無催化劑的情況下反應過程中的能量變化 | |
| D. | 圖④表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲線 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com