
 .
.
分析 X、Y、Z、W為原子序數依次增大的四種短周期主族元素,X的最外層電子數比內層電子數多1,原子只能有2個電子層,最外層電子數為3,故X為B元素;Y是短周期元素中金屬性最強的元素,則Y為Na;Z的最外層電子數與次外層電子數之比為3:4,則Z為S元素,W原子序數最大,故W為Cl,據此解答.
解答 解:X、Y、Z、W為原子序數依次增大的四種短周期主族元素,X的最外層電子數比內層電子數多1,原子只能有2個電子層,最外層電子數為3,故X為B元素;Y是短周期元素中金屬性最強的元素,則Y為Na;Z的最外層電子數與次外層電子數之比為3:4,則Z為S元素,W原子序數最大,故W為Cl.
(1)Y為Na元素,原子結構示意圖為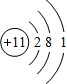 ,故答案為:
,故答案為: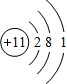 ;
;
(2)W為Cl元素,最高價氧化物對應水化物的化學式為HClO4,Y和W形成的化合物為NaCl,電子式為 ,故答案為:HClO4;
,故答案為:HClO4; ;
;
(3)隔絕空氣加熱,Na單質可與X的氧化物B2O3反應制備B單質,該反應的化學方程式為:6Na+B2O3$\frac{\underline{\;\;△\;\;}}{\;}$2B+3Na2O,故答案為:6Na+B2O3$\frac{\underline{\;\;△\;\;}}{\;}$2B+3Na2O;
(4)S2Cl2與水反應生成一種能使品紅溶液褪色的氣體為二氧化硫,只有一種元素化合價發生改變,故S元素化合價降低,轉移0.3mol電子生成二氧化硫為0.1mol,故有0.3molS原子發生還原反應,根據電子轉移守恒可知S元素在還原產物中的化合價為0,故生成S,同時生成HCl,該反應的化學方程式為2S2Cl2+2H2O═3S↓+SO2↑+4HCl,故答案為:2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
點評 本題考查結構性質位置關系應用,推斷元素是解題關鍵,側重考查學生運用知識分析問題、解決問題的能力,難度中等.


科目:高中化學 來源: 題型:解答題
 汽車尾氣治理的方法之一是在汽車的排氣管上安裝一個“催化轉化器”.
汽車尾氣治理的方法之一是在汽車的排氣管上安裝一個“催化轉化器”.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 閱讀并分析下列兩個材料.
閱讀并分析下列兩個材料.| 物質 | 熔點/℃ | 沸點/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇 (C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 (C3H8O3) | 17.9 | 290 | 1.26 | 能跟水和乙醇 以任意比互溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 平衡向逆反應方向移動 | B. | a+b<c+d | ||
| C. | Y的體積分數減小 | D. | X的轉化率下降 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 【實驗化學】
【實驗化學】
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com