
| A. | 為延長食品保質期,可向其中大量添加苯甲酸鈉等防腐劑 | |
| B. | 催化轉化機動車尾氣為無害氣體,能消除酸雨和霧霾的發生 | |
| C. | PM2.5是指空氣中氮氧化物和硫氧化物含量之和 | |
| D. | “地溝油”可以制成肥皂,從而提高資源的利用率 |
分析 A.過量的防腐劑會損害人體的健康;
B.化轉化機動車尾氣為無害氣體,只能減少酸雨和霧霾的發生,不可能消除;
C.PM2.5是指空氣中直徑≤2.5μm的顆粒物;
D.將“地溝油”制成肥皂,可以變廢為寶.
解答 解:A.過量的食品防腐劑會危害人體健康,故A錯誤;
B.化轉化機動車尾氣為無害氣體,只能減少酸雨和霧霾的發生,不可能消除,故B錯誤;
C.PM2.5是指空氣中直徑≤2.5μm的顆粒物,不是指空氣中氮氧化物和硫氧化物含量之和,故C錯誤;
D.“地溝油”,是一種質量極差、極不衛生的非食用油,將它制成肥皂,實際是使用了油脂的皂化反應,將非食用油變成肥皂,可以提高資源的利用率,故D正確;
故選:D.
點評 本題考查了常見食品添加劑、地溝油等生活中常見的物質的性質,熟悉相關物質的性質是解題關鍵,注意酸雨的成因、pM2.5的概念,題目難度不大.


 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案科目:高中化學 來源: 題型:解答題

| 物質 | 開始沉淀的pH值 | 完全沉淀的pH值 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.4 | 4.4 |
| Cr (OH)3 | 4.6 | 5.9 |
| Fe(OH)2 | 7.5 | 9.7 |
| Bi(OH)3 | 0.7 | 4.5 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
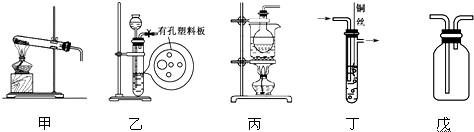
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
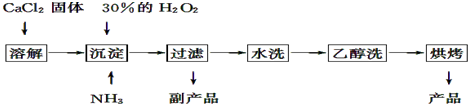
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
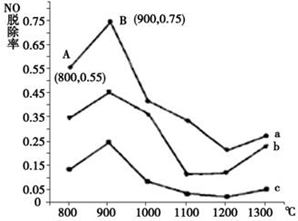 硫、氮氧化物是形成酸雨、霧霾等環境污染的罪魁禍首,采用合適的措施消除其污染是保護環境的重要舉措.
硫、氮氧化物是形成酸雨、霧霾等環境污染的罪魁禍首,采用合適的措施消除其污染是保護環境的重要舉措.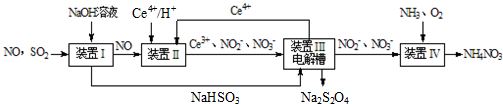
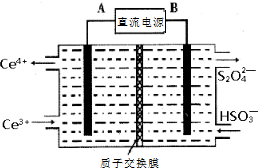
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
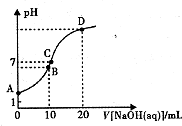 常溫下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH與NaOH溶液的體積關系如圖所示.下列說法不正確的是( )
常溫下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH與NaOH溶液的體積關系如圖所示.下列說法不正確的是( )| A. | A點溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}A)}$增大 | |
| B. | B點:c( HA -)>c(H+)>c(A2一)>c(H2A) | |
| C. | C點:c(Na+)=c(HA-)+2c( A2-) | |
| D. | 水電離出來的c(OH-):B點>D點 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用硅酸鈉與鹽酸反應制備硅膠:SiO32-+2H+═H2SiO3(膠體) | |
| B. | FeI2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 少量NaHSO4 溶液與Ba(OH)2 溶液反應:H++OH-+SO42-+Ba2+═H2O+BaSO4↓ | |
| D. | FeCl3溶液中通入SO2,溶液黃色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
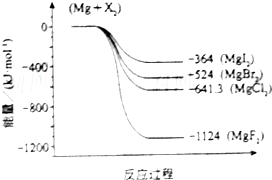 鎂化合物和氯氣均具有廣泛用途,請回答下列問題:
鎂化合物和氯氣均具有廣泛用途,請回答下列問題:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com