
為除去粗鹽中的Ca2+、Mg2+、Fe3+、![]() 以及泥沙等雜質,某同學設計了一種制備精鹽的實驗方案,步驟如下(用于沉淀的試劑稍過量):
以及泥沙等雜質,某同學設計了一種制備精鹽的實驗方案,步驟如下(用于沉淀的試劑稍過量):


(1)判斷BaCl2已過量的方法是______________________________________。
(2)第④步中,相關的離子方程式是_____________________________________。
(3)若先用鹽酸調pH再過濾,將對實驗結果產生影響,其原因是
__________________________________________________。
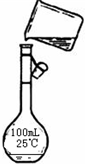
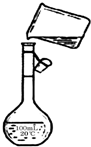
(4)為檢驗精鹽純度,需配制150 mL 0.2 mol·L-1 NaCl(精鹽)溶液,上圖是該同學轉移溶液的示意圖,圖中的錯誤是______________________________________。
(1)取第②步后的上層清液1~2滴于點滴板上,再滴入1~2滴BaCl2溶液,若溶液未變渾濁,則表明BaCl2已過量?
(2)Ca2++CO2-3====CaCO3↓,Ba2++CO2-3====BaCO3↓??
(3)在此酸度條件下,會有部分沉淀溶解,從而影響制得精鹽的純度?
(4)未用玻璃棒引流;未采用150 mL容量瓶?
(1)鑒別SO2-4的特征試劑為含Ba2+的溶液,可取②步的上層清液再加BaCl2,看是否還產生沉淀來判斷,若沒有白色沉淀產生,證明BaCl2已過量。?
(2)第④步的目的是為了除去Ca2+和過量的Ba2+,因此離子方程式應有Ca2++CO2-3==== CaCO3↓,Ba2++CO2-3====BaCO3↓。
(3)如果先加鹽酸調pH再過濾,可能使部分沉淀溶解,導致所得食鹽不純。?
(4)配制一定物質的量濃度溶液時,要求所選容量瓶的容積應與待配制溶液的體積相等,即150 mL容量瓶;轉移溶液時應用玻璃棒引流,而圖中所示沒有按要求做。


科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
2- 4 |

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 為除去粗鹽中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等雜質,某同學設計了一種制備精鹽的實驗方案,步驟如下(用于沉淀的試劑稍過量):
為除去粗鹽中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等雜質,某同學設計了一種制備精鹽的實驗方案,步驟如下(用于沉淀的試劑稍過量):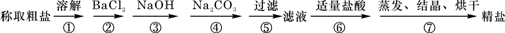
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
 aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液
aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com