
一定溫度下的密閉容器中存在如下反應:H2(g)+I2(g) 2HI(g);已知c始(H2)=0.4mol•L-1,c始(I2)=1mol•L-1,經測定該反應在該溫度下的平衡常數K=64,當H2的轉化率為50%時,下列結論正確的是
2HI(g);已知c始(H2)=0.4mol•L-1,c始(I2)=1mol•L-1,經測定該反應在該溫度下的平衡常數K=64,當H2的轉化率為50%時,下列結論正確的是
A.該反應達到平衡狀態
B.該反應正在向左方向進行
C.達平衡狀態時,H2的轉化率應為96.3%
D.增大H2的量,該反應平衡常數將減小
科目:高中化學 來源:2015-2016學年四川省高二下期中化學試卷(解析版) 題型:選擇題
下列指定的比值為2:1的是
A.0.2mol/L和0.1mol/L的氨水中c(OH-)之比
B.H2S溶液中c(H+)與c(S2-)之比
C.Na2S溶液中c(Na+)與c(S2-)之比
D.Na2O2晶體中陽離子與陰離子個數之比
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高二5月月考化學試卷(解析版) 題型:實驗題
根據題目要求,回答下列問題:
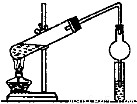
Ⅰ.某同學用乙醇、乙酸和濃硫酸制取乙酸乙酯,裝置如圖所示。
(1)裝置中干燥管的作用是__________
(2)小試管中的試劑加入順序為_____________
A. 濃硫酸 乙醇 乙酸 B. 乙醇 濃硫酸 乙酸 C. 乙酸 濃硫酸 乙醇
II.已知:R﹣OH+HX→R﹣X+H2O如圖是實驗室用乙醇與濃硫酸和溴化鈉反應制備溴乙烷的裝置,圖中省去了加熱裝置。
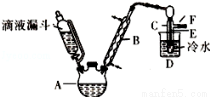
乙醇、溴乙烷、溴有關參數數據見表:
乙醇 | 溴乙烷 | 溴 | |
狀態 | 無色液體 | 無色液體 | 深紅棕色液體 |
密度/g•cm﹣3 | 0.79 | 1.44 | 3.1 |
沸點/℃ | 78.5 | 38.4 | 59 |
(3)本實驗中應采取的加熱方式是 。
(4)為除去產品中的Br2,最好選擇下列溶液來洗滌產品_______。
A.氫氧化鈉 B.亞硫酸鈉 C.碘化鈉
III.電爐加熱時用純氧氣氧化管內樣品,根據產物的質量確定有機物的組成,下圖裝置是用燃燒法確定有機物M分子式的常用裝置。

(5)E裝置中氧化銅的作用是___________________;
(6)若準確稱取有機物M (只含C、H、O三種元素中的兩種或三種) 0.70 g,經充分燃燒后,測得A管質量增加2.2 g,B管質量增加0.9 g,在相同條件下該M蒸氣相對氫氣的密度為42,則M的分子式為 。若有機物M不能使溴水褪色,且其核磁共振氫譜只有一個吸收峰,則M的結構簡式為 。若該有機物M能使溴水褪色,且所有碳原子共面,則M的結構簡式為 。
(7)根據上述要求,不考慮空氣的影響,組裝該套裝置的先后順序為 (請按ABCDE的方式填寫)。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高二5月月考化學試卷(解析版) 題型:選擇題
下列實驗能獲得成功的是( )
A.制取溴苯:鐵屑、溴水、苯
B.要檢驗鹵代烴中的鹵素原子,可向其溶液中加入AgNO3溶液
C.苯酚有酸性,可使紫色石蕊變紅
D.用溴水可鑒別苯、CCl4、苯乙烯
查看答案和解析>>
科目:高中化學 來源:2015-2016學年安徽師大附中高二下期中化學試卷(解析版) 題型:選擇題
一定條件下,體積為2L的密閉容器中,1molX和3molY進行反應:X(g)+3Y(g)?2Z(g),經12s達到平衡,生成0.6mol Z.下列說法正確的是
A.若該反應的△H<0,升高溫度,平衡常數K減小
B.若增大X的濃度,則物質Y的轉化率減小
C.以X濃度變化表示的反應速率為 mol(L•s)
mol(L•s)
D.12s后將容器體積擴大為10L,Z的平衡濃度變為原來的
查看答案和解析>>
科目:高中化學 來源:2015-2016學年安徽師大附中高二下期中化學試卷(解析版) 題型:選擇題
下列說法可表示方法正確的是
A.將0.5molN2和1.5molH2充入一密閉容器中充分反應,放出熱量19.6kJ則該熱化學方程式為N2(g)+3H2(g) 2NH3(g) △H=-39.2kJ•mol-1
2NH3(g) △H=-39.2kJ•mol-1
B.由C(石墨)=C(金剛石);△H=+1.9kJ•mol-1,可知金剛石比石墨穩定
C.在稀溶液中:H++OH-═H2O△H=-57.3kJ/mol,若將含40.0gNaOH的稀溶液與稀醋酸完全中和,放出的熱量小于57.3kJ
D.在101kPa時,2gH2完全燃燒生成液態水,放出285.8kJ熱量,氫氣燃燒的熱化學方程式表示為:2H2(g)+O2(g)═2H2O(l)△H= -285.8kJ/mol
查看答案和解析>>
科目:高中化學 來源:2015-2016學年浙江省高一下期中化學試卷(解析版) 題型:實驗題
I、某研究性學習小組為了驗證CH4是否具有還原性,設計了如下實驗:
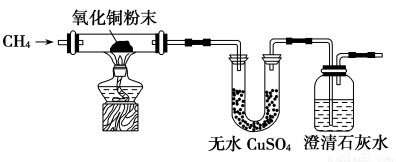
(1)實驗過程中觀察到無水CuSO4逐漸變藍,澄清石灰水出現渾濁現象,則CH4與CuO反應的化學方程式為____ __ 。
(2)研究小組將CH4通入溴水時,發現溴水逐漸褪色,你認為原因可能是____ 。
請設計一個實驗方案證明你的結論(用文字表示,不必畫實驗裝置圖)___ _____________ 。
II、(1)工業上用電石-乙炔生產氯乙烯的反應如下:CaO+3C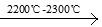 CaC2+CO
CaC2+CO
CaC2+2H2O CH≡CH+Ca(OH)2 CH≡CH+HCl
CH≡CH+Ca(OH)2 CH≡CH+HCl 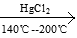 CH2=CHCl
CH2=CHCl
電石-乙炔法的優點是流程簡單,產品純度高,而且不依賴與石油資源。
電石-乙炔法的缺點是: 、 。
(2)乙烷和氯氣反應可制得ClCH2CH2Cl,ClCH2CH2Cl加熱分解得到氯乙烯和氯化氫。請設計以乙烯和氯氣為原料制取氯乙烯的方案(其他原料自選),用化學方程式表示(不必注明反應條件)。要求:①反應產生的氯化氫必須用于氯乙烯的制備;②不再產生其他廢液。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年浙江省高二下期中化學試卷(解析版) 題型:選擇題
使用前不需檢查是否漏液的儀器是
A. 容量瓶 B. 分液漏斗 C. 酸式滴定管 D. 蒸餾燒瓶
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com