
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2017屆湖北省高三上學期8月月考化學試卷(解析版) 題型:選擇題
中學常見物質A、B、C、D、E、X,存在下圖轉化關系 (部分生成物和反應條件略去)。下列推斷不正確的是( )

A.若D是一種強堿,則A、B、C均可與X反應生成D
B.若D為NaCl,且A可與C反應生成B,則E可能是CO2
C.若D是一種白色沉淀,在空氣中最終變為紅褐色,則A可能是鐵
D.若D是一種強酸,則A既可以是單質,也可以是化合物,且D可與銅反應生成B或C
查看答案和解析>>
科目:高中化學 來源:2017屆江西省高三上學期第二次月考化學試卷(解析版) 題型:填空題
霧霾天氣多次肆虐我國中東部地區。其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一。汽車尾氣凈化的主要原理為:2NO(g)+2CO(g) 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(1)若在一定溫度下,將1.0molNO、0.5molCO充入0.5L固定容積的容器中,達到平衡時NO、CO、CO2、N2物質的量分別為:0.8mol、0.3mol、0.2mol、0.1mol,該反應的化學平衡常數K= ;若保持溫度不變,再向容器中充入CO、N2各0.3mol,平衡將 移動(填“向左”、“向右”或“不”)。
(2)CO可以合成甲醇。已知:
①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H=-1529kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1;
③2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1;
則CO(g)+2H2(g) CH3OH(g) △H= kJ·mol-1。
CH3OH(g) △H= kJ·mol-1。
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省沙市高三上學期第三次考試化學試卷(解析版) 題型:實驗題
某工廠的廢金屬屑的主要成分為鋁、鐵和銅,某化學興趣小組在學習了元素及其化合物的相關知識后,設計了如圖1實驗流程,用該工廠的金屬廢料制取氯化鋁、綠礬晶體(FeSO4·7H2O)和膽礬晶體(CuSO4·5H2O)。


請回答:
(1)寫出步驟Ⅱ反應的離子方程式: 。
(2)步驟Ⅰ、Ⅱ、Ⅲ進行的實驗操作中均需用到的玻璃儀有 。
(3)進行步驟Ⅱ時,該小組用如圖2所示裝置及試劑制取CO2并將制得的氣體通入溶液A中一段時間后,觀察到燒杯中產生的白色沉淀會逐漸減少,原因是 。
(4)從溶液E得到綠礬晶體的實驗操作是 、 過濾。
(5)用固體F制備CuSO4溶液,可設計如圖3三種途徑:
寫出途徑③中反應的化學方程式: ,用途徑①制備CuSO4溶液時,混酸中硫酸和硝酸的最佳物質的量之比為 。
(6)用惰性電極電解硫酸銅溶液一段時間后,陰極增重3.2g。陽極產生 L氣體(標準狀況)。
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省沙市高三上學期第三次考試化學試卷(解析版) 題型:選擇題
用Cl2生產某些含氯有機物時會產生副產物HCl。利用反應A,可實現氯的循環利用。
反應A: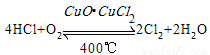
已知:I.反應A中,4molHCl被氧化,放出115.6kJ熱量。
II.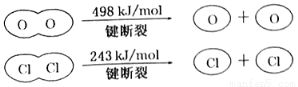
判斷下列說法正確的是
A.反應A的△H>-115.6kJ·mol-1
B.H2O中H—O鍵比HCl中H—Cl鍵弱
C.由II中的數據判斷氯元素的非金屬性比氧元素強
D.斷開1molH—O鍵與斷開1molH—Cl鍵所需能量相差31.9kJ
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省沙市高三上學期第三次考試化學試卷(解析版) 題型:選擇題
將過量的CO2分別通入①CaCl2溶液;②Na2SiO3溶液;③Ca(ClO)2溶液;④飽和Na2CO3溶液。最終溶液中有白色沉淀析出的是
A.①②③④ B.②④ C.①②③ D.②③
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省沙市高三上學期第三次考試化學試卷(解析版) 題型:選擇題
化學與生產、生活、環境等社會實際密切相關。下列敘述正確的是
A.“滴水石穿、繩鋸木斷”不涉及化學變化
B.明礬凈水的原理和“84”消毒液消毒的原理不相同
C.氟利昂作制冷劑會加劇霧霾天氣的形成
D.汽車尾氣中含有的氮氧化物,是汽油不完全燃燒造成的
查看答案和解析>>
科目:高中化學 來源:2017屆海南省高三上學期第一次月考化學試卷(解析版) 題型:選擇題
下圖是用球棍模型表示的某有機反應的過程,則該反應的有機反應類型是( )

A.取代反應 B.加成反應 C.聚合反應 D.酯化反應
查看答案和解析>>
科目:高中化學 來源:2017屆福建省高三上適應性考試(一)理綜化學試卷(解析版) 題型:實驗題
內鋅礦的主要成分為ZnS,含有雜質PbS、CuS、FeS、SiO2等,以閃鋅礦制備氯化鋅的流程如圖所示。
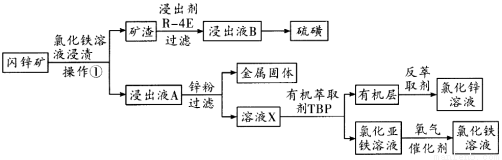
請回答下列問題:
(1)配制氯化鐵浸漬液時要求pH為0.8~1之間,pH太高則 ,pH太低,浸漬礦石會產生有害氣體 ,操作①是 。由氯化鋅溶液制備氯化鋅晶體的方法是 。
(2)高沸點溶劑R—4E幾乎不溶于水,120℃時硫在R—4E里的溶解度為365g,室溫時溶解度為35.9g,從浸出液B提取硫的方法是 。硫是工業制備硫酸的原料,現有1噸礦石,硫的總含量為24%,最多制備濃度98%的硫酸 噸。
(3)氯化鐵與硫化鋅發生反應: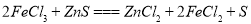 ,則氯化鐵與FeS反應的方程式為 。
,則氯化鐵與FeS反應的方程式為 。
(4)溶液X的成分的化學式為 ,該流程中循環使用的物質是 。
(5)由氯化亞鐵溶液制備氯化鐵溶液,可以用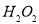 、
、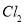 ,但生產成本高。酸性條件下,使用催化劑在50℃左右通入氧氣轉化的成本極低,反應的離子方程式為 。
,但生產成本高。酸性條件下,使用催化劑在50℃左右通入氧氣轉化的成本極低,反應的離子方程式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com