
【題目】Garnet型固態電解質被認為是鋰電池最佳性能固態電解質。LiLaZrTaO材料是目前能達到最高電導率的Garnet型電解質。某Garnet型可充電鋰電池放電時工作原理如圖所示,反應方程式為:LixC6+Li1-xLaZrTaO![]() LiLaZrTaO+6C,下列說法不正確的是
LiLaZrTaO+6C,下列說法不正確的是
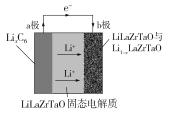
A.放電時,a極為負極,發生氧化反應
B.LiLaZrTaO固態電解質起到傳導Li+的作用
C.充電時,b極反應為:LiLaZrTaO -xe-=xLi++Li1-xLaZrTaO
D.充電時,每轉移xmol電子,a極增重7 g
【答案】D
【解析】
根據題干信息,由電池工作原理圖分析可知,電池工作放電時,Li+向b極移動,則b極為電池的正極,發生還原反應,電極反應式為:xLi++Li1-xLaZrTaO+xe-=LiLaZrTaO,a極為電池的負極,發生氧化反應,據此分析解答問題。
A.根據上述分析可知,電池工作放電時,a極為電池的負極,發生氧化反應,A選項正確;
B.由電池工作原理圖可知,LiLaZrTaO固態電解質起到傳導Li+的作用,B選項正確;
C.電池充電時,b極為陽極,發生氧化反應,電極反應式為:LiLaZrTaO -xe-=xLi++Li1-xLaZrTaO,C選項正確;
D.充電時,a極為陰極,發生的反應為6C+ xe-+xLi+=LixC6:每轉移xmol電子,增重7x g,D選項錯誤;
答案選D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】Cu3N具有良好的電學和光學性能,在電子工業領域、航空航天領域、國防領域、通訊領域以及光學工業等領域中,發揮著廣泛的、不可替代的巨大作用。
(1)N位于周期表中第________周期________族。
(2)C、N、O三種元素的第一電離能由大到小的順序為________________。
(3)Cu+的電子排布式為________________________,其在酸性溶液中不穩定,可發生歧化反應生成Cu 2+和Cu,但CuO在高溫下會分解成Cu2O,試從結構角度解釋高溫下CuO為何會生成Cu2O________________________________________。
(4)在Cu的催化作用下,乙醇可被空氣氧化為乙醛,乙醛分子中碳原子的雜化方式是________,乙醛分子中H﹣C﹣O的鍵角________乙醇分子中的H﹣C﹣O的鍵角(填“大于”、“等于”或“小于”)。
(5)[Cu(H2O)4]2+中的兩個H2O被Cl-取代有兩種不同的結構,則[Cu(H2O)4]2+的結構為________形。
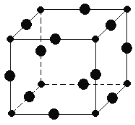
(6)Cu3N的晶胞結構如圖,N3﹣的配位數為________,Cu+半徑為a pm,N3﹣半徑為bpm,Cu3N的密度________________g/cm3。(阿伏加德羅為常數用NA表示)(1pm=10﹣10 cm)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】AlN新型材料應用前景廣泛,其制備與性質研究成為熱點。
相關數據如下:
物質 | 熔點/℃ | 沸點/℃ | 與N2反應溫度/℃ | 相應化合物分解溫度/℃ |
Al | 660 | 2467 | >800 | AlN:>2000 (>1400升華) AlCl3:(>181升華) |
Mg | 649 | 1090 | >300 | Mg3N2:>800 |
(1)AlN的制備。
① 化學氣相沉積法。
Ⅰ.一定溫度下,以AlCl3氣體和NH3為原料制備AlN,反應的化學方程式是____________________。
Ⅱ.上述反應適宜的溫度范圍是______℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 鋁粉直接氮化法。
Al與N2可直接化合為AlN固體,AlN能將Al包裹,反應難以繼續進行。控制溫度,在Al粉中均勻摻入適量Mg粉,可使Al幾乎全部轉化為AlN固體。該過程發生的反應有:__________________、_________和2Al + N2 ![]() 2AlN。
2AlN。
③碳熱還原法。
以Al2O3、C(石墨)和N2為原料,在高溫下制備AlN。
已知:ⅰ. 2Al2O3(s) 4Al(g) + 3O2(g) H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) H 3 =-318 kJ·mol-1
運用平衡移動原理分析反應ⅱ對反應ⅰ的可能影響:______________________________________。
(2)AlN的性質。AlN粉末可發生水解。相同條件下,不同粒徑的AlN粉末水解時溶液pH的變化如圖所示。
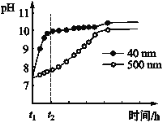
① AlN粉末水解的化學方程式是____________________________________。
② 解釋t1-t2時間內兩條曲線差異的可能原因:_______________________________。
(3)AlN含量檢測。向a g AlN樣品中加入足量濃NaOH溶液,然后通入水蒸氣將NH3全部蒸出,將NH3用過量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,則樣品中AlN的質量分數是________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用“吸收—電解”循環法脫除煙氣中的SO2,可減少對大氣的污染。室溫下,電解液K再生的裝置如圖所示,其中電解液的pH隨![]() 變化的關系見下表,下列對此判斷正確的是
變化的關系見下表,下列對此判斷正確的是
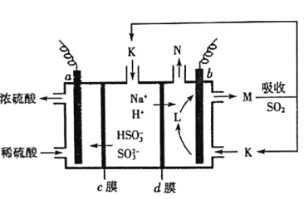
電解液 | n(SO32-):n(HSO3-) | pH |
K | 9:91 | 6.2 |
L | 1:1 | 7.2 |
M | 91:9 | 8.2 |
A.當電解液呈中性時溶液中:![]()
B.再生液M吸收SO2主反應的離子方程式為:![]()
C.HSO3-在b極發生的電極反應式為:![]()
D.若產生標準狀況下2.24L氣體N,則d膜上共通過0.2mol陽離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理研究化學反應有重要意義。
(1)一氯胺(NH2Cl)是飲用水的二級消毒劑,水解生成一種具有強烈殺菌消毒作用的物質:
①NH2Cl中Cl元素的化合價為_____________。
②NH2Cl發生水解反應的化學方程式為_____________________________。
(2)SO2和CO均為燃煤產生的煙道氣中有害成分,在催化作用下可利用二者相互反應進行無害化處理并回收硫。有關資料如圖1所示。則:
①常溫常壓下,質量均為11.2g的CO(g)和S(s)分別完全燃燒生成CO2(g)或SO2(g),放出的熱量前者比后者多________kJ。
②SO2(g)+2CO(g)=S(s)+2CO2(g) △H=___________________.
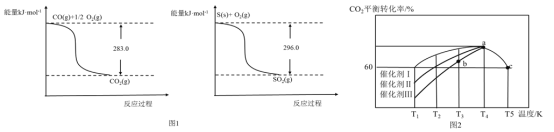
(3)在一定條件下,向恒容密閉容器中充入1.0molCO2和3.0molH2,在一定溫度范圍內發生如下轉化:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-xkJ/mol x>0)。在不同催化劑作用下,相同時間內CO2的轉化率隨溫度的變化如圖2所示:
①催化效果最佳的是催化劑__________(選填“I”、“Ⅱ”或“Ⅲ”);b點v(正)___v(逆)(選填“>”、“<”或“=”)
②此反應在a點時已達到平衡狀態,a點的轉化率比c點高的原因是_____________
(4)常溫下,H2CO3的電離常數為:Ka1=4×10-7,Ka2=4×10-11。已知0.1mol/LNH4HCO3溶液的pH=8,則在此溶液中:
①下列有關離子濃度的關系式中,不正確的是_____(填序號)
A.c(NH4+)>c(HCO3-)>c(OH-)>c(H+)
B.c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(H2CO3)
C.c(H2CO3)-c(CO32-)-c(NH3·H2O)=9.9×10-7mol·L-1
②![]() =________(結果保留三位有效數字)。
=________(結果保留三位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,分別向20mL濃度均為xmol/L的NaCl和Na2CrO4溶液中滴加0.1mol/LAgNO3溶液,滴加過程中![]() 和
和![]() 與AgNO3溶液的體積關系如圖所示。下列說法不正確的是
與AgNO3溶液的體積關系如圖所示。下列說法不正確的是
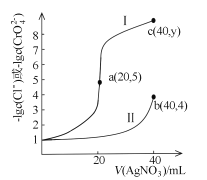
A.x =0.1B.曲線I代表NaCl溶液
C.Ksp(Ag2CrO4)約為4×10-12D.y=9
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在分析化學的電位法中,甘汞電極常做參比電極,它是由金屬汞及其難溶鹽Hg2Cl2和KCl溶液組成的電極。Hg2Cl2(甘汞)毒性較小,而HgCl2(升汞)有劇毒。
(1)K元素的基態原子的電子填充于_____個不同的能級。
(2)Hg的價層電子排布式為5d106s2,Hg元素位于元素周期表的_______區。
(3)Hg2Cl2在400~500℃時升華,由此推測Hg2Cl2的晶體類型為____。
(4)KCl和NaCl相比,____ 的熔點更高,原因是________。
(5)把NH4Cl和HgCl2按一定比例混合,在密封管中加熱時,生成某種晶體,其晶胞如圖所示。用X-射線衍射法測得該晶體的晶胞為長方體(晶胞參數a=b =419pm、c=794pm),每個NH4+可視為被8個Cl-圍繞,距離為335pm,Cl-與Cl-盡可能遠離。
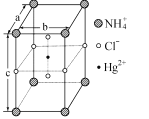
①該晶體的化學式為________。
②晶體中Cl-的空間環境_____________(填“相同”或“不相同”)。用題中數據說明理由_______________
③設阿伏加德羅常數的值為NA,則該晶體的密度為_______g/cm3(列出計算表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫恒容條件下,不能表明反應: 2NO2(g)![]() 2NO(g)+O2(g) 已達平衡狀態的是
2NO(g)+O2(g) 已達平衡狀態的是
A. 容器中顏色不再改變 B. 混合氣平均相對分子質量不再改變
C. 混合氣密度不再改變 D. 單位時間內生成n mol O2的同時生成2n mol NO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用價層電子對互斥理論(VSEPR)可以預測許多分子或離子的空間構型,有時也能用來推測鍵角大小,下列判斷正確的是
A. SO2是直線形分子B. SO3是三角錐形分子
C. BF3的鍵角為120°D. PCl3是平面三角形分子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com