
 在溫度T1和T2下,X2(g)和H2(g)反應生成HX(g)的平衡常數K如下表:
在溫度T1和T2下,X2(g)和H2(g)反應生成HX(g)的平衡常數K如下表:| 化學方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
分析 (1)K值越大,說明反應的正向程度越大,即轉化率越高,反應的正向程度越小,說明生成物越不穩定,越易分解;
(2)①溫度為T1時,在0~tAmin內,△n(HI)=nA mol,v(HI)=$\frac{{n}_{A}mol}{3L×{t}_{A}min}$,$\frac{v({H}_{2})}{v(HI)}=\frac{1}{2}$;
②先拐先平數值大,T2>T1,升高溫度,HI的物質的量減小,平衡逆向移動,則正反應為放熱反應,K減小,氣體的總質量不變,體積為3L,因此密度是一個定值;
(3)根據HF屬于弱電解質,則在加水不斷稀釋時,電離程度增大,電離平衡保持向正反應方向移動,并注意溫度不變時,電離平衡常數不變來解答;
(4)AgCl懸濁液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),加入碘離子,平衡正移,氯化銀轉化為碘化銀.
解答 解:(1)K值越大,說明反應的正向程度越大,即轉化率越高,d正確;反應的正向程度越小,說明生成物越不穩定,越易分解,因此選項c正確;而選項a、b與K的大小無直接聯系,
故答案為:cd;
(2)①溫度為T1時,在0~tAmin內,△n(HI)=nA mol,v(HI)=$\frac{{n}_{A}mol}{3L×{t}_{A}min}$=$\frac{{n}_{A}}{3{t}_{A}}$mol/(L•min),
由$\frac{v({H}_{2})}{v(HI)}=\frac{1}{2}$可得v(H2)=$\frac{1}{2}×$$\frac{{n}_{A}}{3{t}_{A}}$mol/(L•min)=$\frac{{n}_{A}}{6{t}_{A}}$mol/(L•min),
故答案為:$\frac{{n}_{A}}{6{t}_{A}}$mol/(L•min);
②先拐先平數值大,T2>T1,升高溫度,HI的物質的量減小,平衡逆向移動,則正反應為放熱反應,K減小,由于氣體的總質量不變,體積為3L,因此密度是一個定值,
故答案為:a、b;
(3)A、因HF為弱酸,則濃度為0.1mol•L-1HF溶液加水不斷稀釋,促進電離,平衡正向移動,電離程度增大,n(H+)增大,但c(H+)不斷減小,故A錯誤;
B、因電離平衡常數只與溫度有關,則Ka(HF)在稀釋過程中不變,故B錯誤;
C、因稀釋時一段時間電離產生等量的H+和F-,溶液的體積相同,則兩種離子的濃度的比值不變,但隨著稀釋的不斷進行,c(H+)不會超過10-7mol•L-1,c(F-)不斷減小,則比值變小,故C錯誤;
D、因Ka(HF)=$\frac{c({F}^{-})×c({H}^{+})}{c(HF)}$,當HF溶液加水不斷稀釋,促進電離,c(F-)不斷減小,Ka(HF)不變,則$\frac{c({H}^{+})}{c(HF)}$增大,故D正確;
故答案為:D;
(4)已知AgCl懸濁液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq);向盛有10mL 0.1mol•L-1 AgNO3溶液的試管中滴加0.1mol•L NaCl溶液,有AgCl白色沉淀生成,由于AgI溶解度比AgCl溶解度小,I-與Ag+結合,使平衡體系中c(Ag+)減小,使平衡向右移動,
故答案為:AgI溶解度比AgCl溶解度小,使AgCl(s)?Ag+(aq)+Cl-(aq)體系中c(Ag+)減小,使平衡向右移動.
點評 本題考查知識點較多,涉及化學反應速率的計算、化學平衡的影響因素、弱電解質的電離、沉淀溶解平衡等知識點,難度中等,為高頻考點,掌握有關四大平衡的化學反應原理是答題關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 酸性溶液中:Al3+、Fe3+、SO42-、SCN- | |
| B. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| C. | 強堿性溶液中:Na+、NO3-、HCO3-、SO32- | |
| D. | 強酸性溶液中:Na+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ) ③C2H5OH ④CH3COOH.
) ③C2H5OH ④CH3COOH.| A. | ①>②>③>④ | B. | ②>③>④>① | C. | ②>④>①>③ | D. | ④>③>②>① |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a<0 | |
| B. | 使用催化劑能加快反應速率并提高反應物的平衡轉化率 | |
| C. | 降低溫度,CO的平衡轉化率降低 | |
| D. | 降低溫度,各物質的濃度不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
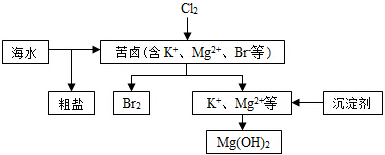
| A. | 向苦鹵中通入Cl2,目的是為了提取溴 | |
| B. | 除去粗鹽中的SO42-雜質,可以選擇BaCl2等試劑 | |
| C. | 工業生產常選用Ca(OH)2作為沉淀劑 | |
| D. | 電解法制取金屬鎂時,原料一般是灼燒Mg (OH)2得到的MgO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使新鮮的紅玫瑰花褪色(HCl) | B. | 新制氯水呈淺黃綠色(Cl2) | ||
| C. | 加入小蘇打固體,有氣泡產生(H+) | D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 次氯酸鈣的化學式:CaClO | |
| B. | 氟離子結構示意圖: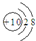 | |
| C. | 質量數為127的鋇原子:127Ba | |
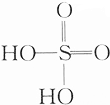
| D. | 硫酸的電離方程式:H2SO4═2H+SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 皮膚上沾了少量苯酚,先用稀NaOH溶液洗,再用水沖洗 | |
| B. | 做完銀鏡反應的試管,應該用稀硫酸清洗 | |
| C. | 試管中殘留的苯酚,先用稀NaOH溶液洗,再用水沖洗 | |
| D. | 粘有酚醛樹脂的試管,可先用水浸泡幾分鐘,軟化,再清洗 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)已知在常溫常壓下:
(1)已知在常溫常壓下:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com