
| ||
| ||


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:
| A、甲的分子數比乙的分子數多 |
| B、甲的體積比乙大 |
| C、兩氣體的氣體摩爾體積相同 |
| D、甲的相對分子質量比乙的相對分子質量小 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 實驗方法 | 實驗現象 | 結論 |
| 在溶液中加入KSCN溶液 | 固體物質中有FeCl3 | |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液顏色無明顯變化 | 固體物質中不含 |
查看答案和解析>>
科目:高中化學 來源: 題型:
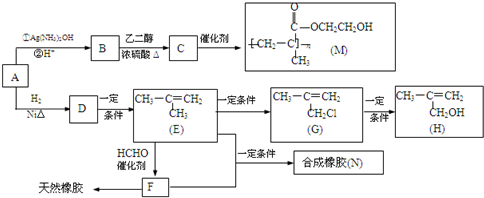
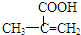 ,該不飽和酸有多種同分異構體,請寫出屬于酯類且含有碳碳雙鍵的同分異構體的結構簡式
,該不飽和酸有多種同分異構體,請寫出屬于酯類且含有碳碳雙鍵的同分異構體的結構簡式查看答案和解析>>
科目:高中化學 來源: 題型:
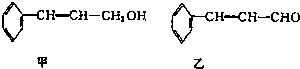
| 分子式 | C16H14O2 |
| 部分性質 | 能使Br2/CCl2褪色能在稀硫酸中水解 |
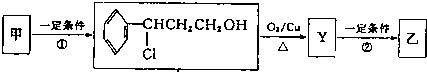
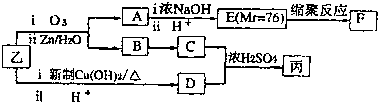
| ⅰO2 |
| ⅱZn/H2O |
| ⅰ濃NaOH |
| ⅱH+ |
查看答案和解析>>
科目:高中化學 來源: 題型:
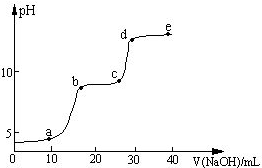 某研究性學習小組擬探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液時,生成氫氧化物沉淀的過程.
某研究性學習小組擬探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液時,生成氫氧化物沉淀的過程.| 較大量存在的含金屬元素的離子 | 檢驗方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、溶液中可能存在Al3+ |
| B、溶液中可能存在Br- |
| C、溶液中一定存在CO32- |
| D、溶液可能存在Ba2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com