

| NaHCO3溶液 BaCl2濃度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 渾濁 | 渾濁 | 少許渾濁 |
| 0.1mol•L-1 | 渾濁 | 少許渾池 | 無現糴 |
| 0.02mol•L-1 | 少許渾油 | 尤現象 | 尤現象 |
分析 (1)鹽酸與碳酸鈣反應生成二氧化碳氣體和氯化鈣,其中鹽酸易揮發,據此選擇儀器;
(2)①飽和澄清石灰水與碳酸鈉和碳酸氫鈉均能反應生成碳酸鈣沉淀,據此解答;
②(i)計算此時溶液中鋇離子濃度與碳酸根濃度的乘積與該溫度下碳酸鋇的溶度積常數比較即可;
(ii)鋇離子與碳酸氫根離子反應生成二氧化碳和碳酸鋇沉淀;
③取用實驗室中分析純與樣品進行pH的測算比較即可;
④發生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,由圖中所給數據可知在180℃時,固體的殘留率為63.09%,根據方程式計算100g固體完全分解時剩余固體的質量,據此分析.
解答 解:(1)C為發生裝置,鹽酸與碳酸鈣反應生成二氧化碳氣體和氯化鈣,其中鹽酸易揮發,故應先選取碳酸氫鈉除去混合氣體中的HCl,故儀器連接順序為:CAB,
故答案為:CAB;
(2)①飽和澄清石灰水與碳酸鈉和碳酸氫鈉均能反應生成碳酸鈣沉淀,故甲方案不可行,
故答案為:不可行;
②(i)兩種溶液等體積混合后,溶液中鋇離子濃度=$\frac{0.2mol/L}{2}$=0.1mol/L,0.1 mol•L-1 NaHC03溶液電離出的c(CO32-)為0.0011 mol•L-1,故Q=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9,故會產生沉淀,
故答案為:Qc=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9;
(ii)鋇離子與碳酸氫鈉電離出的碳酸根結合生成碳酸鋇沉淀,從而促進了碳酸氫根的電離,使其向生成碳酸根和氫離子的方向移動,故離子反應方程式為:Ba2++2HCO3-=BaCO3↓+CO2↑+H2O,
故答案為:Ba2++2HCO3-=BaCO3↓+CO2↑+H2O;
③丙方案為測定pH法,由于碳酸氫鈉屬于強堿弱酸鹽,溶于水中配成V mL的溶液,利用準確度較高的pH計進行樣品的pH值,然后測量等質量等濃度的分析純NaHC03的pH值,最后比較即可,
故答案為:另取等質量的分析純NaHC03溶于水中配成V mL的溶液,用pH計測pH;
④發生反應為2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,由圖中所給數據可知在180℃時,固體的殘留率為63.09%,
設碳酸氫鈉為100g,
則2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
168 106
100g xg
解得:x=63.09g,
即理論上碳酸氫鈉每有100g分解應生成63.09g固體,
故由圖可知100g樣品分解恰好生成固體為63.09g,故此樣品只含有為NaHCO3,
故答案為:制得的固體樣品是純凈的NaHCO3.
點評 本題考查了制備方案的設計、碳酸氫鈉的性質、Ksp的有關計算等知識,題目難度較大,熟練掌握碳酸氫鈉的性質以及其熱分解原理是解決本題的關鍵,試題側重考查學生的分析、理解能力及化學實驗能力.


 優翼小幫手同步口算系列答案
優翼小幫手同步口算系列答案科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
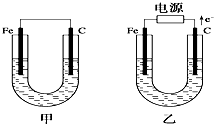 如圖所示,甲、乙兩池電極材料都是鐵棒和碳棒,請回答下列問題:
如圖所示,甲、乙兩池電極材料都是鐵棒和碳棒,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-867 kJ•mol-1 | |
| B. | CH4催化還原NOx為N2的過程中,若x=1.6,則轉移電子3.2 mol | |
| C. | 若0.2 mol CH4還原NO2至N2,在上述條件下放出的熱量為173.4 kJ | |
| D. | 若用標準狀況下4.48 L CH4還原NO2至N2,整個過程中轉移電子3.2 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.04 | B. | 0.04mol/(L.s) | C. | 0.08mol(L.s) | D. | 0.04mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com