
【題目】某反應可表示為:mM+nH++O2===xM2++yH2O,則x值為 ( )
A. 2 B. 4 C. 6 D. 9
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】硫酸亞鐵銨[(NH4)2Fe(SO4)2]是一種重要的化工原料,下列有關說法正確的是( )
A.Na+、Fe3+、NO3﹣、Cl2都可在該物質的溶液中大量共存
B.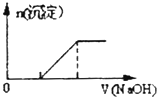
向O.1mo1﹣L﹣1該物質的溶液中清加0.Lmol﹣1NaOH溶液,生成沉淀的物質的量與逐滴加入NaOH溶液體積關系如圖所示
C.檢驗該物質中Fe2+是否變質的方法是向該物質的溶液中滴入幾滴KSCN溶液,觀察溶液是否變紅色
D.向該物質的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的離子方程式為:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由單質A與化合物B(固體B)兩種粉末組成的混合物, 在一定條件下可按下圖所示發生轉化:

請回答:
(1)A的原子結構示意圖是_________________,B的化學式____________________。
(2)反應②中發生的反應離子方程式_________________________________________。
(3)沉淀H→沉淀I的化學方程式___________________________________________。
(4)溶液E→沉淀J的離子方程式___________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵是應用最廣泛的金屬,鐵的氯化物、氧化物以及高價鐵的含氧酸鹽均為重要化合物。
(1)請寫出Fe與水蒸氣反應的化學方程式:_____________。
(2)在實驗室中,FeCl2可用鐵粉和______(填名稱)反應制備。
(3)Fe3O4可用多種方法制得,其中由一種單質和一種化合物通過化合反應制備的化學方程式為______。
(4)紅磚是用黏土高溫燒結而成的,因其含有Fe2O3呈紅色或棕紅色而得名,常用作建筑材料。請設計一個簡單實驗證明紅磚中含有Fe3+:_________________。
(5)現有一含有FeCl2 和FeCl3的混合物樣品,實驗測得n(Fe):n(C1)=1:2.1,則該樣品中FeCl3的物質的量分數為_________。
(6)高鐵酸鉀(K2FeO4)是一種強氧化劑,可作為水處理劑和高容量電池材料。FeCl3和KClO在強堿性條件下反應可制取K2FeO4,其反應的離子方程式為:____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從石油裂解中得到的1,3-丁二烯可進行以下多步反應,得到氯丁橡膠和富馬酸。
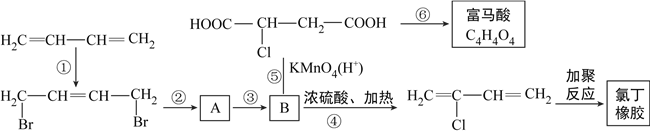
(1)B的名稱為2-氯-1,4-丁二醇,請你寫出B的結構簡式____________________。
(2)請你寫出第②步反應的化學方程式:______________________________。
(3)反應①~⑥中,屬于消去反應的有______________________________。
(4)有機合成中的路線和步驟選擇非常重要,若將第②步和第③步的順序調換,則B結構將是____________________。
(5)如果沒有設計③和⑥這兩步,直接用KMnO4/H+處理物質A,導致的問題是:______________________________。
(6)某種有機物的分子式為C5H6O4,它的分子中所含官能團的種類、數目均與富馬酸相同,不考慮順反異構,它可能的結構有__________種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求回答下列問題:
(1)最簡單的烴分子空間構型為____________________。
(2)衡量一個國家石油化工水平的標志是__________(填名稱)的產量。
(3)2,4,6-三硝基甲苯(TNT)的結構簡式為____________________。
(4)經催化加氫后生成異戊烷的炔烴結構簡式為____________________。
(5)能用高錳酸鉀溶液鑒別的是__________(填選項)
a.裂化汽油和直餾汽油 b.苯和甲苯
c.順-2-丁烯和反-2-丁烯 d.乙醇和甘油
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:某廢水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的幾種,為分析其成分,分別取廢水樣品100 mL,進行了三組實驗,其操作和有關圖像如下所示:
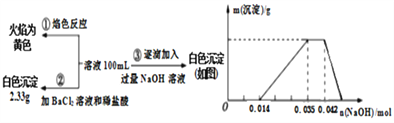
請回答下列問題:
(1)根據上述3組實驗可以分析廢水中一定不存在的陰離子是______________,一定存在的陽離子是______________________。
(2)寫出實驗③圖像中沉淀達到最大量且質量不再發生變化階段發生反應的離子反應方程式:_____________________________________________。
(3)分析圖像,在原溶液中c(NH4+)與c(Al3+)的比值為________,所得沉淀的最大質量是____g。
(4)若通過實驗確定原廢水中c(Na+)=0.14 mol·L-1,c(NO3-)=____________ mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴碘主要存在于海水中,有“海洋元素”的美稱。海水中的碘富集在海藻中,我國海帶產量居世界第一,除供食用外,大量用于制碘。實驗室提取碘的途徑如下所示:
![]()
(1)碘元素在海水中以________存在(填“游離態”或“化合態”)。
(2)灼燒過程中用到的實驗儀器有鐵三角架、酒精燈、______、_____、______。
(3)操作①中需用到玻璃棒,則玻璃棒的作用是_______________。
(4)向酸化后的水溶液加入適量3% H2O2溶液,發生反應的化學方程式為________。
(5)操作③是分液,則操作②是___________;操作④是_____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com