
【題目】某氯化亞鐵和氯化鐵的混合物,現要測定其中FeCl2和FeCl3的物質的量,按以下步驟進行實驗:
(1)將混合物配制成250mL的待測溶液,所用到的玻璃儀器除燒杯、膠頭滴管、玻璃棒外,還必須有_______(填儀器名稱)。
(2)取25.00mL待測溶液,向其中通入標準狀況下336mLCl2恰好將Fe2+氧化為Fe3+,請寫出通入氯氣發生的反應的離子方程式:_______________;由此可知原溶液中n(FeCl2)=___________mol。
(3)向(2)反應后所得到溶液中加入過量的NaOH溶液,然后進行過濾,將所得沉淀洗滌干凈,加熱、灼燒該沉淀,冷卻至室溫后,準確稱量可知,得到紅棕色固體粉末3.2g,由此可以確定原溶液中c(FeCl3)=________mol·L—1 。
(4)檢驗Fe3+中含有Fe2+ 的方法是____________。
【答案】250mL容量瓶 2Fe2++Cl2=2Fe3++2Cl— 0.3 0.4 滴加酸性KmnO4溶液,若溶液褪色,則證明Fe3+中含有Fe2+
【解析】
(1)依據配制250mL的待測溶液,所需的玻璃儀器分析缺少的儀器;
(2)將Cl2通入FeCl2溶液中,生成FeCl3,依據反應的化學方程式計算25ml溶液中FeCl2的物質的量;
(3) 向(2)反應后所得到溶液中加入過量的NaOH溶液,生成Fe(OH)3沉淀,Fe(OH)3受熱分解生成Fe2O3,得到紅棕色固體粉末3.2g的Fe2O3,其中的Fe是原溶液中的FeCl2、FeCl3中的鐵的總和,由此計算原溶液中的c(FeCl3);
(4)因Fe2+具有 還原性可是酸性高錳酸鉀溶液褪色,以此選擇檢驗Fe2+的試劑和方法。
(1)配制250mL的待測溶液,需要的玻璃儀器除燒杯、膠頭滴管、玻璃棒外,還必須有250ml的容量瓶;
本題答案為:250ml的容量瓶。
(2)將Cl2通入FeCl2溶液中,生成FeCl3,離子方程式為:2Fe2+![]() Cl2=2Fe3+
Cl2=2Fe3+![]() -,依據反應的離子方程式,336mLCl2的物質的量為:n(Cl2)=
-,依據反應的離子方程式,336mLCl2的物質的量為:n(Cl2)=![]() =0.015mol,設336mLCl2可氧化Fe2+的物質的量為x,則有1:2=0.015:x,則x=0.03mol,原溶液中含n(Fe2+)=0.03mol
=0.015mol,設336mLCl2可氧化Fe2+的物質的量為x,則有1:2=0.015:x,則x=0.03mol,原溶液中含n(Fe2+)=0.03mol![]() 10=0.3mol,n(FeCl2)= n(Fe2+)=0.3mol;
10=0.3mol,n(FeCl2)= n(Fe2+)=0.3mol;
本題答案為:2Fe2+![]() Cl2=2Fe3+
Cl2=2Fe3+![]() 2Cl-,0.3。
2Cl-,0.3。
(3)向(2)反應后所得到溶液中加入過量的NaOH溶液,生成Fe(OH)3沉淀,Fe(OH)3受熱分解生成Fe2O3,依據題意25ml溶液中n(Fe)=2n(Fe2O3)=2![]() =0.04mol,由于原溶液含n(Fe2+)=0.03mol,所以含n(Fe3+)=0.04mol-0.03mol=0.01mol因為n(FeCl3)= n(Fe3+),所以25ml溶液中含n(FeCl3)=0.01mol,故250ml溶液中含三氯化鐵的物質的量為:n(FeCl3)=0.1mol,其濃度為:c(FeCl3)=
=0.04mol,由于原溶液含n(Fe2+)=0.03mol,所以含n(Fe3+)=0.04mol-0.03mol=0.01mol因為n(FeCl3)= n(Fe3+),所以25ml溶液中含n(FeCl3)=0.01mol,故250ml溶液中含三氯化鐵的物質的量為:n(FeCl3)=0.1mol,其濃度為:c(FeCl3)=![]() =0.4mol/L,
=0.4mol/L,
本題答案為:0.4。
(4)因Fe2+具有還原性,可使酸性高錳酸鉀溶液褪色,故滴加酸性KmnO4溶液,若溶液褪色,則證明Fe3+中含有Fe2+;
本題答案為:滴加酸性KmnO4溶液,若溶液褪色,則證明Fe3+中含有Fe2+。


 輕松暑假總復習系列答案
輕松暑假總復習系列答案科目:高中化學 來源: 題型:
【題目】當溫度高于500 K時,科學家成功利用二氧化碳和氫氣合成了乙醇(可逆反應),這在節能減排、降低碳排放方面具有重大意義。回答下列問題:
(1)該反應的化學方程式______________________________________________。
(2)在恒容密閉容器中,判斷上述反應達到平衡狀態的依據是________。
a.體系壓強不再改變
b.H2的濃度不再改變
c.氣體的密度不隨時間改變
d.單位時間內消耗H2和CO2的物質的量之比為3:1
(3)在一定壓強下,測得由CO2制取CH3CH2OH的實驗數據中,起始投料比、溫度與CO2的轉化率的關系如圖。

根據圖中數據
①降低溫度,平衡向________方向移動。
②在700 K、起始投料比![]() =1.5時,H2的轉化率為________。
=1.5時,H2的轉化率為________。
③在500 K、起始投料比![]() =2時,達到平衡后H2的濃度為a mol·L-1,則達到平衡時CH3CH2OH的濃度為________。
=2時,達到平衡后H2的濃度為a mol·L-1,則達到平衡時CH3CH2OH的濃度為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】液體燃料電池相比于氣體燃料電池具有體積小等優點。一種以液態肼(N2H4)為燃料的電池裝置如圖所示,該電池用空氣中的氧氣作為氧化劑,KOH溶液作為電解質溶液。下列關于該電池的敘述正確的是
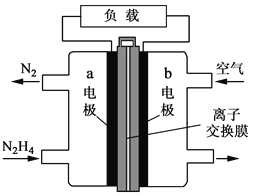
A. b極發生氧化反應
B. a極的反應式:N2H4+4OH--4e-=N2↑+4H2O
C. 放電時,電流從a極經過負載流向b極
D. 其中的離子交換膜需選用陽離子交換膜
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將等物質的量的X、Y氣體充入一個密閉容器中,在一定條件下發生如下反應并達到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。當改變某個條件并達到新平衡后,下列敘述正確的是( )
2Z(g) ΔH<0。當改變某個條件并達到新平衡后,下列敘述正確的是( )
A. 升高溫度,X的體積分數減小
B. 增大壓強(縮小容器體積),Z的濃度不變
C. 保持容器體積不變,充入一定量的惰性氣體,Y的濃度不變
D. 保持容器體積不變,充入一定量的Z,X的體積分數增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學課外興趣小組為探究銅跟濃硫酸的反應情況,用如圖所示裝置進行有關實驗:

(1)B是用來收集實驗中產生的氣體的裝置,但未將導管畫全,請在圖上把導管補充完整_________。
(2)實驗中他們取6.4 g銅片和12 mL 18 mol·L1濃硫酸放在圓底燒瓶中共熱,直到反應完畢,最后發現燒瓶中還有銅片剩余,該小組學生根據所學的化學知識認為還有一定量的硫酸剩余。
①寫出銅跟濃硫酸反應的化學方程式:__________________;
②為什么有一定量的余酸但未能使銅片完全溶解,你認為原因是__________________;
③下列藥品中能夠用來證明反應結束后的燒瓶中確有余酸的是________(填編號)。
A.鐵粉 B.BaCl2溶液 C.銀粉 D.Na2CO3溶液
(3)裝置C中試管D內盛裝的是品紅溶液,當B中氣體收集滿后,有可能觀察到的現象是_____________,待反應結束后,向C中燒杯內加入沸水,D中觀察到的現象是_____________。
(4)實驗裝置C有可能造成環境污染,試用最簡單的方法加以解決,__________________(實驗用品自選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機化合物“利尿酸”是一種常見的興奮劑,其分子結構如下圖,下列說法正確的是

A. 利尿酸是芳香烴
B. 利尿酸與AgNO3溶液反應有白色沉淀生成
C. 一定條件下,利尿酸能發生取代反應、加成反應和酯化反應
D. 1mol利尿酸與飽和碳酸鈉溶液反應能放出1 mol CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水芹烯是一種具有祛痰、抗菌、殺蟲作用的添加劑,由水芹烯合成聚合物H的路線如圖所示。
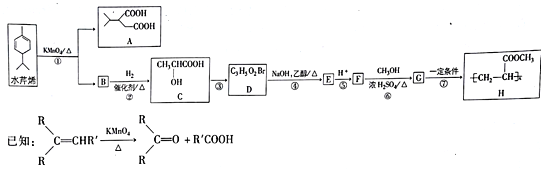
回答下列問題:
(1)水芹烯的分子式為_______ ,C的系統命名為_________________,反應④的反應類型為____。
(2)D分子中的官能團為(寫名稱)_______________,B的結構簡式為___________ 。
(3)反應⑥的化學反應方程式為___________________________________。H在NaOH水溶液中發生水解反應的化學方程式為________________________________________。
(4)M是G的同分異構體,且能與NaHCO3反應生成CO2,則M的可能結構有________種(考慮立體異構)
(5)乙酸異丙酯CH3COOCH(CH3)2是重要的有機化工中間體,寫出以2-甲基-2-丁烯為原料(其他無機試劑任選)制備乙酸異丙酯的合成路線_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com