
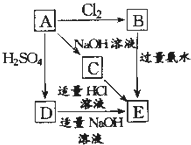
 在如圖式中,E是不溶于水的白色膠狀物質,試推斷:
在如圖式中,E是不溶于水的白色膠狀物質,試推斷:分析 A能與硫酸、氫氧化鈉反應,則A為兩性物質,且A能與氯氣反應,故A為Al,可知B為AlCl3,氯化鋁與氨水反應生成生成氫氧化鋁與氯化銨,且E是不溶于水的白色膠狀物質,則E為Al(OH)3,Al與氫氧化鈉溶液反應生成偏鋁酸鈉與氫氣,則C為NaAlO2,C為NaAlO2與適量的鹽酸溶液反應生成氫氧化鋁沉淀,Al與硫酸反應生成硫酸鋁與氫氣,而D能與適量的氫氧化鈉溶液反應生成E(氫氧化鋁),故D為Al2(SO4)3,據此解答.
解答 解:A能與硫酸、氫氧化鈉反應,則A為兩性物質,且A能與氯氣反應,故A為Al,可知B為AlCl3,氯化鋁與氨水反應生成生成氫氧化鋁與氯化銨,且E是不溶于水的白色膠狀物質,則E為Al(OH)3,Al與氫氧化鈉溶液反應生成偏鋁酸鈉與氫氣,則C為NaAlO2,C為NaAlO2與適量的鹽酸溶液反應生成氫氧化鋁沉淀,Al與硫酸反應生成硫酸鋁與氫氣,而D能與適量的氫氧化鈉溶液反應生成E(氫氧化鋁),故D為Al2(SO4)3,
(1)上述分析可知A為Al,B為AlCl3,C為NaAlO2,D為Al2(SO4)3,E為Al(OH)3,故答案為:Al;AlCl3;NaAlO2;Al2(SO4)3;Al(OH)3;
(2)①D-E是硫酸鋁和適量的氫氧化鈉溶液反應生成氫氧化鋁沉淀,反應的離子方程式為:Al3++3OH-=Al(OH)3↓,
故答案為:Al3++3OH-=Al(OH)3↓;
②反應B-E的反應是氯化鋁與氨水反應生成氫氧化鋁沉淀與氯化銨,屬于離子反應,反應離子方程式為:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案為:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
點評 本題考查無機物推斷,涉及Al元素單質化合物性質與轉化,A發生的反應是推斷突破口,再結合轉化關系推斷,側重對化學方程式的考查,難度中等.


 孟建平小學滾動測試系列答案
孟建平小學滾動測試系列答案科目:高中化學 來源: 題型:選擇題
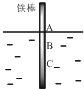 將一根較純鐵棒垂直沒入水中,由于深水處溶氧量較少,一段時間后發現AB段產生較多鐵銹,BC段腐蝕嚴重,下列關于此現象的說法錯誤的是( )
將一根較純鐵棒垂直沒入水中,由于深水處溶氧量較少,一段時間后發現AB段產生較多鐵銹,BC段腐蝕嚴重,下列關于此現象的說法錯誤的是( )| A. | 鐵棒AB段發生反應為O2+4e-+2H2O=4OH- | |
| B. | 腐蝕過程中在鐵棒上會產生微電流,且方向是AB段到BC段 | |
| C. | 向水中加入一定量硫酸鉀固體后,對鐵棒的生銹速率幾乎無影響 | |
| D. | 產生這種現象的本質原因是鐵棒所處的化學環境不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HClO4、H2SO4、H3PO4的酸性依次增強 | |
| B. | HCl、HBr、HI的穩定性依次增強 | |
| C. | 鈉、鎂、鋁的還原性依次減弱 | |
| D. | P、S、Cl最高正價依次降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化劑 | B. | 還原劑 | C. | 催化劑 | D. | 反應物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
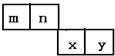 m、n、x、y四種主族元素在周期表里的相對位置如圖所示.已知它們的原子序數總和為46,則:
m、n、x、y四種主族元素在周期表里的相對位置如圖所示.已知它們的原子序數總和為46,則: .
. ,此物質在固態時屬于離子晶體.
,此物質在固態時屬于離子晶體.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | N、P、As的電負性隨原子序數的增大而增大 | |
| B. | 價電子排布為4s24p3的元素位于第四周期第ⅤA族,是p區元素 | |
| C. | 2p和3p軌道形狀均為紡錘形,能量也相等 | |
| D. | 氮原子的最外層電子的軌道表示式: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 實驗現象 | 實驗結論 |
| A | 向鹽酸中加入濃硫酸 | 產生白霧 | 濃硫酸有吸水性 |
| B | 向某紅色溶液中通入SO2氣體 | 紅色褪去 | SO2具有漂白性 |
| C | 將乙醇與濃硫酸共熱產生的氣體通入酸性高錳酸鉀溶液中 | 紫紅色變淺 | 反應生成乙烯 |
| D | 向碳酸鈉溶液中滴加幾滴酚酞后,加熱 | 紅色加深 | 鹽類水解是吸熱反應 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com