
【題目】下列關于實驗室保存藥品的方法,錯誤的是( )
A.過氧化鈉密封保存在細口玻璃瓶中
B.氯水保存在帶磨口玻璃塞的棕色試劑瓶中
C.硫酸亞鐵溶液在保存時應加入鐵粉
D.金屬鈉保存在液體石蠟或煤油中
 七星圖書口算速算天天練系列答案
七星圖書口算速算天天練系列答案 初中學業考試導與練系列答案
初中學業考試導與練系列答案科目:高中化學 來源: 題型:
【題目】若aAm+與bBn-的核外電子排布相同,則下列關系不正確的是
A. b=a-n-mB. 離子半徑Am+<Bn-
C. 原子半徑A<BD. A的原子序數比B大(m+n)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,取濃度相同的NaOH和HCl溶液,以3:2體積比相混合,所得溶液的pH等于12,則原溶液的濃度為
A. 0.01 mol·L-1 B. 0.017 mol·L-1
C. 0.05 mol·L-1 D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】德國化學家凱庫勒研究提出的苯分子結構模型如圖所示:
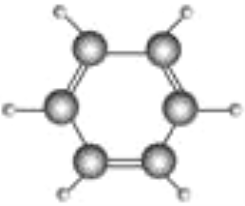
(1)請根據苯的分子結構模型,寫出苯的分子式__________________結構式____________,結構簡式________________。
(2)書寫苯和溴發生取代反應的方程式(Fe或者FeBr3作催化劑)__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂及其化合物在生產、生活中應用廣泛。
Ⅰ.(1)鎂在元素周期表中的位置為___________
(2)鎂的碳化物常見的有MgC2和Mg2C3兩種,可分別發生水解反應生成乙炔和丙二烯,寫出MgC2水解反應的方程式為_________;Mg2C3的電子式為_________.
(3)由Mg可制成“鎂一次氯酸鹽”燃料電池,其裝置示意圖如下圖所示,該電池反應的離子方程式為____________.
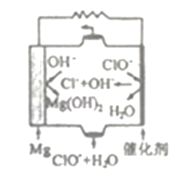
Ⅱ.利用氯堿工業鹽泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生產MgSO4·7H2O的工藝流程如下圖所示。
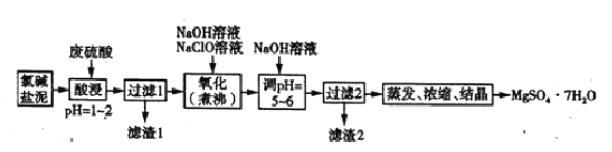
(4)酸浸時,FeCO3與硫酸反應的化學方程式為_____________,為了提高浸取率可采取的措施有_____(填字母)。
a.多次用廢硫酸浸取 b.減小鹽泥粒度并充分攪拌 c.適當延長浸取時間
(5)氧化時,次氯酸鈉溶液將MnSO4氧化為MnO2的離子程式為______________;濾渣2為MnO2和_____________、___________(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,青蒿素為無色針狀晶體,難溶于水,易容有機溶劑,熔點為156-157℃。青蒿素是一種有效的抗瘧藥,某化學興趣小組對青蒿素的提取和組成進行如下的探究。
Ⅰ.提取青高素的方法之一是乙醚浸取法,提取流程如下:
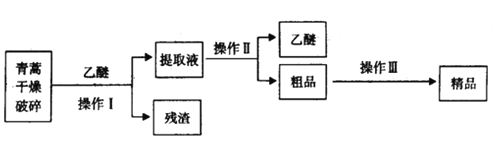
(1)對青蒿進行破碎的目的是___________
(2)操作Ⅰ用到的玻璃儀器是__________,操作Ⅱ的名稱是__________
Ⅱ.燃燒法測定青蒿素的最簡式:
利用下列實驗裝置,將28.2g青蒿素放在燃燒管C中充分燃繞,測出生成的CO2和H2O的質量后,計算得出青蒿素的最簡式。
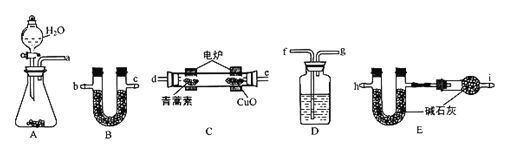
主要實驗步驟如下:
①組裝儀器,并檢查裝置的氣密性。
②先將A裝置的藥品反應一會后,再將C裝置通電反應。
③稱量有關裝置的實驗前后的質量。
請回答下列問題:
(3)儀器各接口的連接順序從左到右依次為_____(每個裝置限用一次)。
(4)①裝置B中的試劑為________,其作用是__________。
②裝置C中CuO的作用是__________。
③裝置D中的試劑為______,其作用是________________。
④裝置E中的試劑為______,其作用是________________。
⑤裝置F中的試劑為______,其作用是_________________。
(5)已知青蒿素是烴的含氧衍生物,用合理連接后的裝置進行實驗,測量數據如表:
裝置質量 | 實驗前/g | 實驗后/g |
B | 22.6 | 42.4 |
E | 80.2 | 146.2 |
則青蒿素的最簡式為_____________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:N2O4(g)![]() 2NO2(g),將裝有N2O4和NO2混合氣體的燒瓶浸入熱水中,燒瓶內混合氣體的顏色逐漸變深。下列結論不能說明該反應已經達到化學平衡狀態的是
2NO2(g),將裝有N2O4和NO2混合氣體的燒瓶浸入熱水中,燒瓶內混合氣體的顏色逐漸變深。下列結論不能說明該反應已經達到化學平衡狀態的是
A. 燒瓶內氣體的質量不再變化
B. 燒瓶內氣體的顏色不再變化
C. 燒瓶內氣體的壓強不再變化
D. N2O4的消耗速率與NO2的消耗速率之比為1:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丙烷在燃燒時能放出大量的熱,它也是液化石油氣的主要成分,作為能源應用于人們的日常生產和生活。已知:
①2C3H8(g) + 7O2 (g)= 6CO(g) + 8H2O(l) △H1=-2741.8 kJ/mol
②2CO(g)+O2(g)= 2CO2(g) △H2 =-566 kJ/mol
(1) 反應C3H8(g) + 5O2(g)= 3CO2(g) + 4H2O (1) 的△H=_______。
(2) 現有lmol C3H8 在不足量的氧氣里燃燒,生成1mol CO 和2mol CO2 以及氣態水,將所有的產物通入一個固定體積為1L 的密閉容器中,在一定條件下發生如下可逆反應:CO(g)+ H2O (g) ![]() CO2(g)+H2(g) △H= +4 1.2 kJ/mol
CO2(g)+H2(g) △H= +4 1.2 kJ/mol
①下列事實能說明該反應達到平衡的是______
a.體系中的壓強不發生變化
b.v正(H2) = v逆(CO)
c.混合氣體的平均相對分子質量不發生變化
d.CO2的濃度不再發生變化
②5min 后體系達到平衡,經測定,H2 為0.8mol,則平衡常數K=_______。
③其他條件不變,向平衡體系中充入少量CO 則平衡常數_____ (填增大、減小或不變)。
(3) 依據(1)中的反應可以設計一種新型燃料電池,一極通入空氣,另一極通入丙烷氣體;燃料電池內部是熔融的摻雜著氧化釔(Y2O3)的氧化鋯(ZrO2)晶體,在其內部可以傳導O2-。在電池內部O2-由______極移向______ 極(填“正”或“負”);電池的負極電極反應式為____________。
(4) 用上述燃料電池和惰性電極電解足量Mg(NO3)2 和NaCl 的混合溶液。電解開始后陰極的現象為____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知氯化銀在水中的溶解平衡為: AgCl(s)Ag+(aq)+Cl﹣(aq),
25℃,其Ksp為:Ksp=[Ag+][Cl﹣]=1.8×10﹣10 mol2L﹣2 . 現把氯化銀(足量)分別放人:
①100mL蒸餾水中;
②100mL 0.1molL﹣1的鹽酸溶液中;
③1000mL 0.1molL﹣l的氯化鋁溶液中;
④100mL0.1molL﹣1的氯化鎂溶液中.
充分攪拌后,相同溫度下,銀離子濃度由大到小的順序是(用序號回答) . 在0.1molL﹣l氯化鋁溶液中,銀離子的物質的量濃度最大可達到 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com