
分析 (1)該反應中,硫元素化合價由0價變為-2價,N元素化合價由+5價變為0價,碳元素化合價由0價變為+4價,根據元素化合價變化判斷氧化劑和還原劑,氧化劑在反應中被還原,還原劑在反應中被氧化,以此解答;
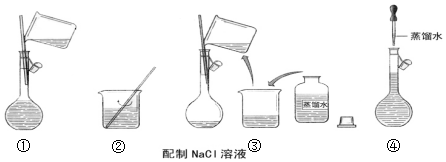
(2)根據配制一定物質的量濃度的溶液步驟排序;
(3)屬于電解質,但熔融狀態下并不導電的為共價化合物的電解質;硫酸氫鈉為強電解質,在溶液中完全電離出鈉離子、氫離子和硫酸根離子;
(4)氯化鐵溶液加熱水解生成氫氧化鐵膠體和氯化氫;氫氧化鐵膠體帶有正電荷,加熱稀硫酸后先發生聚沉現象生成氫氧化鐵沉淀,然后氫氧化鐵沉淀與稀硫酸發生酸堿中和反應生成氯化鐵和水;
(5)CO、氫氣完全燃燒,先設出CO氣體的xL,則氫氣為(10-x)L,利用方程式根據差量法表示出體積變化量,再根據剩余的氣體的體積列方程計算混合物中氣體的體積;由$\frac{1}{2}$x+$\frac{3}{2}$(10-x)=15+10-a計算a的表達式,結合0<x<10計算.
解答 解:(1)反應S+2KNO3+3C═K2S+N2↑+3CO2↑中,S元素化合價由0價降低到-2價,則S為氧化劑,N元素化合價由+5價降低到0價,則KNO3為氧化劑,C元素化合價由0價升高到+4價,則C為還原劑,
故答案為:C;S、KNO3;
(2)配制一定物質的量濃度的NaCl溶液步驟為稱量、溶解、冷卻、移液、洗滌、定容等,所以正確的順序為:②③①④,
故答案為:②③①④;
(3)①Cu ②HCl ③NH3 ④NaCl ⑤CaCO3 ⑥稀硫酸 ⑦NaHSO4,其中屬于電解質,但熔融狀態下并不導電的物質一定為共價化合物型的電解質,滿足體積的有②;
NaHSO4在水溶液中完全電離,其電離方程式為:NaHSO4=Na++H++SO42-,
故答案為:②;NaHSO4=Na++H++SO42-;
(4)將飽和氯化鐵溶液加入沸水中加熱制備Fe(OH)3膠體,反應的化學方程式為:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(膠體)+3 HCl; 向該膠體中逐滴加入稀硫酸,氫氧化鐵膠體先發生聚沉現象生成氫氧化鐵沉淀,然后氫氧化鐵沉淀與稀硫酸反應生成硫酸鐵和水,反應反應為:Fe(OH)3+3H+=Fe3++3H2O,反應現象為:先產生紅褐色沉淀,后來沉淀消失,
故答案為:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(膠體)+3 HCl;先產生紅褐色沉淀,后來沉淀消失;Fe(OH)3+3H+=Fe3++3H2O;
(5)設V(CO)為xL,則V(H2)為(10-x)L,
由2CO+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CO2 △V
2 1 2 1
x $\frac{x}{2}$
2H2+O2$\frac{\underline{\;點燃\;}}{\;}$2H2O△V
2 1 3
(10-x) $\frac{3}{2}$(10-x)
則$\frac{1}{2}$x+$\frac{3}{2}$(10-x)=15+10-15,解得:x=5,
即V(CO)=5L,則V(H2)=(10-x)L=10L-5L=5L,
混合氣體中CO與剩余氣體體積a之間的關系為:$\frac{1}{2}$x+$\frac{3}{2}$(10-x)=15+10-a,
解得:a=10+x,
由于0<x<10,則10<a<20,
故答案為:5;5;10<a<20.
點評 本題考查較為綜合,涉及混合物反應的計算、氧化還原反應、離子方程式的書寫等知識,題目難度中等,(5)為易錯點,明確反應前后體積的變化及該條件下水的狀態是關鍵,學生容易忽略水為液體而導致分析錯誤,注意差量法的利用,簡化計算過程.


科目:高中化學 來源: 題型:選擇題
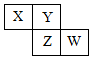 X、Y、Z、W均為短周期元素,它們在元素周期表中相對位置如圖所示,若Z原子的最外層電子數是第一層電子數的3倍,下列說法正確的是( )
X、Y、Z、W均為短周期元素,它們在元素周期表中相對位置如圖所示,若Z原子的最外層電子數是第一層電子數的3倍,下列說法正確的是( )| A. | Y單質與氫氣反應較Z劇烈 | |
| B. | 最高價氧化物對應水化物酸性W比Z弱 | |
| C. | X單質氧化性強于Y單質 | |
| D. | X與W的原子核外電子數相差9 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | 化學變化 | 物理變化 |
| B | 氧化還原反應 | 分解反應 |
| C | 氧化還原反應 | 化合反應 |
| D | 中和反應 | 復分解反應 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 200mL 2 mol/LMgCl2溶液 | B. | 1000mL 2.5 mol/L NaCl溶液 | ||
| C. | 300mL 5 mol/L KCl溶液 | D. | 250mL 1 mol/L FeCl3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267kJ/mol | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534kJ/mol | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534kJ/mol | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;Y2與NaOH溶液反應的產物之一是OY2,該反應的離子方程式為2F2+2OH-=OF2↑+2F-+H2O.
;Y2與NaOH溶液反應的產物之一是OY2,該反應的離子方程式為2F2+2OH-=OF2↑+2F-+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2912 kJ | B. | 3236 kJ | C. | 2953 kJ | D. | 3867 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com