
【題目】A、B、C、D、E、F為原子序數依次增大的前四周期元素,A元素原子最外層電子數是其內層電子數的2.5倍,B元素是地殼中含量最高的元素,C元素的最高化合價和最低化合價的代數和等于0,D元素的單質可用于自來水消毒殺菌,E元素位于周期表的ⅥB族,F的基態原子中有4個未成對電子。
(1)A元素單質的結構式為___________;B元素原子中的未成對電子數為_______________________。
(2)在A的氫化物A2H4分子中,A原子軌道的雜化類型是______;A與B形成的AB2-的空間構型為___________________________。
(3)A、B、C三種元素的第一電離能從大到小的順序為_______________(用元素符號表示)。
(4)基態F3+的核外電子排布式是_____________________;F3+與SCN-絡合得到多種配合物,其中配位數為5的配合物的化學式為__________________;化合物FD3是棕色固體、易潮解,100℃左右時升華,FD3的晶體類型是__________________________。
(5)鐵在不同溫度范圍有不同的晶體結構。室溫下鐵是簡單立方,稱為α鐵(α-Fe)。當溫度升高到912℃,α鐵轉變為面心立方,稱為γ鐵(γ-Fe)。當溫度繼續升高到1394 ℃,γ鐵轉變為體心立方。稱為δ鐵(δ-Fe)。

①γ鐵晶體中鐵原子配位數是____________________。
②δ鐵晶體密度為dg·cm-3,則其晶胞參數(邊長)為__________cm(阿伏加德羅常數用NA表示)。
【答案】 N≡N 2 sp3 V形(或:平面三角型) N>O>Si 1s22s22p63s23p63d5(或:[Ar]3d5) K2Fe(SCN)5 分子晶體 12 ![]()
【解析】分析:A、B、C、D、E、F為原子序數依次增大的前四周期元素,A元素原子最外層電子數是其內層電子數的2.5倍,則A為N,B元素是地殼中含量最高的元素,為O,C元素的最高化合價和最低化合價的代數和等于0,為第四主族元素,結合原子序數大小可知為Si,D元素的單質可用于自來水消毒殺菌,則D為Cl,E元素位于周期表的ⅥB族,則E為Cr,F的基態原子中有4個未成對電子,則F為Fe,結合原子結構特點及元素性質解答。
詳解:依據上述分析可知A、B、C、D、E、F元素依次為:N,O,Si,Cl,Cr,Fe。則
(1)A元素單質為氮氣,氮氣分子內存在1個氮氮三鍵,結構式為N≡N;B元素為氧元素,O原子中的未成對電子數有2個;
(2)A2H4分子為N2H4,N2H4分子中氮原子的價層電子對=3+1=4,含有一個孤電子對,N原子軌道的雜化類型是sp3,A與B形成的NO2-離子中孤對電子數為:(6-2×2)/2=1,因此分子空間構型是V型;
(3)同周期自左而右元素第一電離能呈增大趨勢,但N元素原子2p能級容納3個電子,處于半滿穩定狀態,能量較低,第一電離能高于同周期相鄰元素,故第一電離能:N>O>C,同一主族從上到下第一電離能逐漸增大,則第一電離能:C>Si,則N、O、Si的第一電離能大小為:N>O>Si;
(4)Fe3+的3d軌道含有5個電子,則鐵離子的核外電子排布式為1s22s22p63s23p63d5(或[Ar]3d5),FeCl3溶液與KSCN溶液混合,得到含多種配合物的紅色溶液,其中配位數為5的配合物的化學式是K2Fe(SCN)5;化合物FD3即FeCl3是棕色固體、易潮解、100℃左右時升華,熔沸點低,屬于分子晶體;
(5)①γ鐵晶體中與頂點鐵原子最近的位于面心處,因此鐵原子配位數是12。
②δ鐵晶體含有的鐵原子個數是8×1/2+1=2,密度為dg·cm-3,則![]() ,因此其晶胞參數(邊長)為
,因此其晶胞參數(邊長)為![]() cm(阿伏加德羅常數用NA表示)。
cm(阿伏加德羅常數用NA表示)。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列各物質的分類、名稱(俗名)、化學式都正確的是( )
A.堿性氧化物 氧化鐵 FeOB.酸 硫酸 H2S
C.酸性氧化物 干冰 CO2(固態)D.鹽 石膏 2CaSO4·H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 酸性食物就是吃的時候感覺有酸味的物質
B. 鐵元素和碘元素都是人體必需的微量元素
C. 油脂是能量最高的食物,所以要多吃油脂類食物保證體內能量需求
D. 糖尿病人不能多吃甜食,可以多食用淀粉類的食物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,硫元素表現出還原性的是( )
A. 稀硫酸與鋅粒反應 B. 亞硫酸與氧氣反應
C. 濃硫酸與炭反應 D. Na2SO3固體與濃H2SO4反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表是學習化學的重要工具,它隱含許多信息和規律。下表所列是五種短周期元素的原子半徑及主要化合價(已知鈹的原子半徑為0.089 nm)。
元素代號 | A | B | C | D | E |
原子半徑/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合價 | +2 | +3 | +6,-2 | -1 | -2 |
(1)用元素代號標出它們在元素周期表中對應的位置(以下為周期表的一部分)。
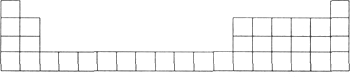
(2)B元素處于周期表中第_______周期第________族。
(3)B的最高價氧化物對應的水化物與C的最高價氧化物對應的水化物反應的離子方程式為_______________。
(4)上述五種元素的最高價氧化物對應水化物酸性最強的是__________(填化學式)。
(5)C、E形成的化合物有__________(填化學式)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國古代四大發明之一的黑火藥是由硫磺粉、硝酸鉀和木炭粉按一定比例混合而成的,爆炸的反應為S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列說法中正確的是 ( )
K2S+N2↑+3CO2↑,下列說法中正確的是 ( )
A. 該反應中的還原劑為KNO3
B. 該反應中C被還原
C. 若消耗32g S,該反應轉移電子數為2 NA
D. 若生成標準狀況下氣體22.4L,則有0.75 mol物質被氧化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計了一種電解法制取Fe(OH)2的實驗裝置(如圖)。通電后,溶液中產生白色沉淀,且較長時間不變色。下列說法中正確的是( )
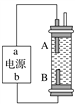
A. 電源中a為負極,b為正極
B. 電解池中的電解液不可以是NaCl溶液
C. B電極發生的反應:2H++2e-===H2↑
D. A、B兩端都必須使用鐵作電極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖表示一些物質間的從屬關系,不正確的是( )
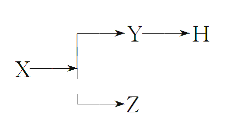
選項 | X | Y | Z | H |
A | 分散系 | 膠體 | 溶液 | 煙 |
B | 電解質 | 酸 | 堿 | 鹽 |
C | 元素周期表的縱行 | 主族 | 副族 | 鹵族 |
D | 化合物 | 共價化合物 | 離子化合物 | 酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫代硫酸鈉(Na2S2O3)是常用的定影劑、還原性分析試劑。Na2S2O3·5H2O是無色晶體,易溶于水,不溶于乙醇,在潮濕的空氣中易潮解,Na2S2O3和甲醛能形成難被碘溶液氧化的化合物。甲、乙兩個興趣小組用下列裝置在實驗室制備硫代硫酸鈉。

回答下列問題:
(1)儀器a的名稱是____________;溶液1是____________。
(2)甲小組按上圖連接好裝置,打開K1、K3,關閉K2,打開儀器a的活塞;片刻后,打開集熱式磁力攪拌器加熱;將氣體通入錐形瓶中,溶液出現黃色渾濁后逐漸消失,相關的化學反應方程式為:①_________________;②Na2SO3+S![]() Na2S2O3。
Na2S2O3。
(3)加熱濃縮至出現少量晶膜,停止加熱,打開K2,關閉K3,用注射器注入無水乙醇后有大量晶體析出。加入乙醇的作用是__________________________________。
(4)乙小組在制備Na2S2O3時進行了改進。將C裝置中的溶液換為Na2CO3和Na2S混合液,其反應為:Na2CO3+Na2S+4SO2=3Na2S2O3+CO2。配制該混合溶液的過程中,先將Na2CO3完全溶解,再將Na2S溶解于Na2CO3的溶液中,其目的是__________________。
(5)測定乙小組產品純度。取3.000gNa2S2O3·5H2O晶體,配成100mL溶液,取20.00mL于錐形瓶,調節溶液的pH至6,加入適量甲醛溶液和Zn(CH3COO)2溶液,過濾,洗滌,在濾液中滴加幾滴淀粉溶液,用0.1000mol/L標準碘溶液滴定,消耗標準碘溶液10.00mL。
①加入適量甲醛溶液和Zn(CH3COO)2溶液的目的是_________________________________。
②該產品中Na2S2O3·5H2O的質量分數為_____________。 (已知:2Na2S2O3+I2=Na2S4O6+2NaIKsp(ZnS)=1.6×10-24 M(Na2S2O3·5H2O)=248g/mol)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com