
 .
.分析 短周期主族元素中,C元素的原子半徑是最大的,則C為Na元素;D元素是地殼中含量最高的金屬元素,則D為Al元素;E、F的原子序數大于Al,均處于第三周期,E的最外層電子數是其電子層數的2倍,則E最外層電子數是6,故E為S元素,F的原子序數大于S元素,則F為Cl元素;B、E同族,則B為O元素;A的最高價氧化物水化物為H2AO3,則A的最高價為+4價,原子序數小于氧,則A為C元素,據此解答.
解答 解:短周期主族元素中,C元素的原子半徑是最大的,則C為Na元素;D元素是地殼中含量最高的金屬元素,則D為Al元素;E、F的原子序數大于Al,均處于第三周期,E的最外層電子數是其電子層數的2倍,則E最外層電子數是6,故E為S元素,F的原子序數大于S元素,則F為Cl元素;B、E同族,則B為O元素;A的最高價氧化物水化物為H2AO3,則A的最高價為+4價,原子序數小于氧,則A為C元素.
(1)A的元素符號為C,C2B2為Na2O2,過氧化鈉屬于離子化合物,其電子式為: ,
,
故答案為:C; ;
;
(2)離子的電子層越多,離子半徑越大,電子層結構相同時,離子的核電荷數越大,離子半徑越小,四種離子的離子半徑大小為:Cl->O2->Na+>Al3+,
故答案為:Cl->O2->Na+>Al3+;
(3)E、F分別為S、Cl元素,二者處于同一周期,原子序數越大,非金屬性越強,則非金屬性較強的為Cl元素;
①物質的存在狀態屬于物理性質,與非金屬性強弱無關,故①錯誤;
②非金屬元素的氣態氫化物越穩定,元素非金屬性越強,氣態氫化物的穩定性:F>E,則非金屬性:Cl>S,故②正確;
③E和F形成的化合物中,E顯正價,說明F的得電子能力更強,則非金屬性Cl>S,故③正確;
④F單質能與E的氫化物發生置換反應,說明氯氣的氧化性大于S,則非金屬性:Cl>S,故④正確;
⑤應描述為E和F的最高價氧化物的水化物的酸性強弱,如HClO為弱酸,硫酸為強酸,故⑤錯誤;
⑥氣態氫化物的還原性:E>F,則對應元素的氧化性恰好相反,即非金屬性:Cl>S,故⑥正確;
故答案為:Cl;②③④⑥;
(4)NaAlO2在溶液中水解得到氫氧化鈉與偏鋁酸(或氫氧化鋁),最終又反應得到NaAlO2,蒸干NaAlO2溶液所得的固體物質為NaAlO2,故答案為:NaAlO2;
(5)C和F可組成化合物甲為NaCl,用惰性電極電解NaCl的水溶液,電解的化學方程式為:2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案為:2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(6)A、B、C三種元素組成的常見化合物乙為Na2CO3,溶液中碳酸根離子水解,溶液呈堿性,水解程度微弱,溶液中氫氧根離子源于碳酸根與碳酸氫根水解、水的電離,故溶液中離子濃度大小順序為:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
溶液中氫氧根離子均源于水,pH=10的Na2CO3溶液中由水電離產生的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol•L-1=10-4mol•L-1,
故答案為:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);10-4.
點評 本題考查位置結構性質關系綜合應用,涉及電子式、微粒半徑比較、非金屬性強弱比較、鹽類水解應用、離子濃度大小比較等,側重考查學生分析解決問題的能力,難度中等.


 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:解答題
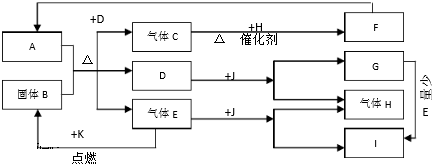
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
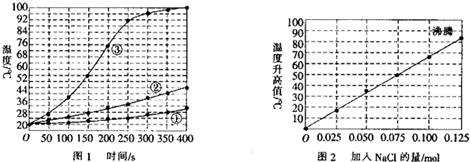
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鎳基含錸單晶合金屬于金屬晶體 | |
| B. | ${\;}_{75}^{185}$Re和 ${\;}_{75}^{187}$Re互稱為核素 | |
| C. | 錸(Re)元素的相對原子質量為186 | |
| D. | 含錸合金比純錸的熔點高、硬度大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na原子最外層有1個電子 | B. | Na單質能跟水反應放出氫氣 | ||
| C. | Na原子比Mg原子更易失去電子 | D. | Na與氧氣在加熱條件下生成氧化鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3CH3+Br2$\stackrel{光照}{→}$ CH3CH2Br+HBr | B. | CH2=CH2+HBr-→CH3CH2Br | ||
| C. | 2C2H2+5O2$\stackrel{點燃}{→}$ 4CO2+2H2O | D. | C4H10$\stackrel{高溫}{→}$ C2H4+C2H6 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com