
 [化學一-選修物質結構與性質]周期表中前四周期中的六種元素A、B、C、D、E、F原子序數依次增大,已知A原子2P軌道有3個未成對電子;化合物B2E的晶體為離子晶體,E原子核外的M層中只有兩對成對電子;C元素是地殼中含量最高的金屬元素;D單質的晶體熔點在同周期形成的單質中是最高的;F2+離子核外各亞層電子均已充滿.
[化學一-選修物質結構與性質]周期表中前四周期中的六種元素A、B、C、D、E、F原子序數依次增大,已知A原子2P軌道有3個未成對電子;化合物B2E的晶體為離子晶體,E原子核外的M層中只有兩對成對電子;C元素是地殼中含量最高的金屬元素;D單質的晶體熔點在同周期形成的單質中是最高的;F2+離子核外各亞層電子均已充滿.| 1 |
| 8 |
| 1 |
| 2 |


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:閱讀理解
+ 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源: 題型:
(12分)本題包括A、B兩小題,分別對應于“物質結構與性質”和“實驗化學”兩個選修模塊的內容。請選定其中一題,并在相應的答題區域內作答。若兩題都做,則按A題評分。
A.黃血鹽(亞鐵氰化鉀,K4[Fe(CN)6] )易溶于水,廣泛用做食鹽添加劑(抗結劑),食鹽中黃血鹽的最大使用量為10 mg·kg-1。黃血鹽經長時間火炒,超過400℃時會分解生成劇毒的氰化鉀。
回答下列問題:
(1)寫出基態Fe2+的核外電子排布式 。K4[Fe(CN)6] 中Fe2+與CN-兩種離子之間的作用力是 。
(2)CN-中碳原子的雜化方式為 ;1molCN-中含有π鍵的數目為 。
(3)金屬鉀、銅的晶體的晶胞結構如下圖(請先判斷對應的圖),鉀、銅兩種晶體晶胞中金屬原子的配位數之比為 。
(4)黃血鹽溶液與稀硫酸加熱時發生非氧化還原反應,生成硫酸鹽和一種與CN-是等電子體的氣態化合物,反應化學方程式為 。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省高三4月雙周練習化學試卷(解析版) 題型:填空題
(12分)本題包括A、B兩小題,分別對應于“物質結構與性質”和“實驗化學”兩個選修模塊的內容。請選定其中一題,并在相應的答題區域內作答。若兩題都做,則按A題評分。
A.黃血鹽(亞鐵氰化鉀,K4[Fe(CN)6] )易溶于水,廣泛用做食鹽添加劑(抗結劑),食鹽中黃血鹽的最大使用量為10 mg·kg-1。黃血鹽經長時間火炒,超過400℃時會分解生成劇毒的氰化鉀。
回答下列問題:
(1)寫出基態Fe2+的核外電子排布式 。K4[Fe(CN)6] 中Fe2+與CN-兩種離子之間的作用力是 。
(2)CN-中碳原子的雜化方式為 ;1molCN-中含有π鍵的數目為 。
(3)金屬鉀、銅的晶體的晶胞結構如下圖(請先判斷對應的圖),鉀、銅兩種晶體晶胞中金屬原子的配位數之比為 。
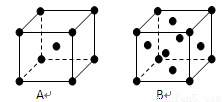
(4)黃血鹽溶液與稀硫酸加熱時發生非氧化還原反應,生成硫酸鹽和一種與CN-是等電子體的氣態化合物,反應化學方程式為 。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省高三下學期開學質量檢測化學試卷 題型:填空題
(12分)本題包括A、B兩小題,分別對應于“物質結構與性質”和“實驗化學”兩個選修模塊的內容。請選定其中一題,并在相應的答題區域內作答。若兩題都做,則按A題評分。
A.黃血鹽(亞鐵氰化鉀,K4[Fe(CN)6] )易溶于水,廣泛用做食鹽添加劑(抗結劑),食鹽中黃血鹽的最大使用量為10 mg·kg-1。黃血鹽經長時間火炒,超過400℃時會分解生成劇毒的氰化鉀。
回答下列問題:
(1)寫出基態Fe2+的核外電子排布式 。K4[Fe(CN)6] 中Fe2+與CN-兩種離子之間的作用力是 。
(2)CN-中碳原子的雜化方式為 ;1molCN-中含有π鍵的數目為 。
(3)金屬鉀、銅的晶體的晶胞結構如下圖(請先判斷對應的圖),鉀、銅兩種晶體晶胞中金屬原子的配位數之比為 。

(4)黃血鹽溶液與稀硫酸加熱時發生非氧化還原反應,生成硫酸鹽和一種與CN-是等電子體的氣態化合物,反應化學方程式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com