
分析 (1)氯化鋁的熔點為190℃(2.02×103 Pa),但在180℃就開始升華,可知熔沸點低,與分子晶體的性質相似;
(2)離子晶體在熔融時破壞離子鍵;
(3)根據還原1mol Fe2O3(s)放熱的熱量結合方程式計算.
解答 解:(1)氯化鋁的熔點為190℃(2.02×103 Pa),但在180℃就開始升華,可知熔沸點低,與分子晶體的性質相似,可知由共價鍵形成的共價化合物,可利用熔融狀態下不能導電來實驗證明,
故答案為:共價化合物; 氯化鋁在熔融狀態下不能導電;
(2)離子晶體在熔融時破壞離子鍵,NaHSO4屬于離子晶體熔融狀態下電離出鈉離子和硫酸氫根離子,則電離方程式為:NaHSO4(熔融)=Na++HSO4-,
故答案為:離子; NaHSO4═Na++HSO4-;
(3)用CO(g)還原l mol Fe203(s),放熱24.8kJ,標注物質聚集狀態和對應焓變得到熱化學方程式為:3CO(g)+Fe2O3(s)=2Fe(s)+3CO2(g)△H=-24.8 kJ/mol,
故答案為:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol.
點評 本題考查較為綜合,涉及化學鍵、晶體的類型、熱化學方程式的書寫,為高頻考點,根據晶體的構成微粒及微粒間的作用力來分析解答,題目難度不大.


 名校通行證有效作業系列答案
名校通行證有效作業系列答案科目:高中化學 來源: 題型:選擇題
 重鉻酸鉀又名紅礬鉀,是化學實驗室中的一種重要分析試劑.工業上以鉻酸鉀(K2CrO4)為原料,采用電化學法制備重鉻酸鉀(K2Cr2O7).制備裝置如圖所示(陽離子交換膜只允許陽離子透過). 制備原理:2CrO42-(黃色)+H+?Cr2O72-(橙色)+H2O.下列說法正確的是( )
重鉻酸鉀又名紅礬鉀,是化學實驗室中的一種重要分析試劑.工業上以鉻酸鉀(K2CrO4)為原料,采用電化學法制備重鉻酸鉀(K2Cr2O7).制備裝置如圖所示(陽離子交換膜只允許陽離子透過). 制備原理:2CrO42-(黃色)+H+?Cr2O72-(橙色)+H2O.下列說法正確的是( )| A. | 電解時惰性電極應與直流電源的負極相連 | |
| B. | 通電后陰極室產生的現象為:產生無色氣體,溶液由無色變黃色 | |
| C. | 制備過程中總的離子方程式為:2CrO42-+3H2O=Cr2O72-+2OH-+2H2↑+O2↑ | |
| D. | 若實驗開始時在右室中加入38.8克的K2CrO4,tmin后測得右室中K與Cr的物質的量之比為3:2,此時電路中轉移電子的物質的量為0.1mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
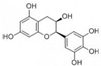
| A. | 分子中所有的原子共面 | |
| B. | 1mol EGC與4mol NaOH恰好完全反應 | |
| C. | 易發生氧化反應和取代反應,一定條件下可發生加成反應 | |
| D. | 易發生水解反應和顯色反應,一定條件下可發生消去反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | c為正極、d為負極 | |
| B. | 電路中電子的流動方向:b-d-CuCl2溶液-c-a | |
| C. | 電解過程中,d電極質量增加 | |
| D. | 電解過程中,氯離子濃度不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子序數為23 | |
| B. | 最高價氧化物為As2O3,為酸性氧化物 | |
| C. | 原子半徑比鈣小 | |
| D. | 氣態氫化物分子式為AsH3,穩定性強于NH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 如果XY2是共價化合物,則X與Y的原子序數不可能相差1 | |
| B. | 如果X與Y的原子序數相差6,則共價化合物XY2可溶于強堿溶液 | |
| C. | 如果X與Y的原子序數相差5,則離子化合物XY2不溶于水 | |
| D. | 如果XY2是離子化合物,則X與Y的原子序數可能相差9 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com