
| 選項 | 實驗操作 | 現象 | 結論 |
| A | 將過量的CO2通入CaCl2溶液中 | 無白色沉淀出現 | 生成Ca(HCO3)2可溶于水 |
| B | 過量的Fe粉加入HNO3溶液中,充分反應后,滴入KSCN溶液 | 有氣泡產生,溶液變紅 | 有氫氣生產,稀將Fe氧化為Fe3+ |
| C | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出現 | AgCl比AgI更難溶 |
| D | 將SO2通入Ba(NO3)2中 | 有白色沉淀產生 | 有BaSO4沉淀生產 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化碳不與氯化鈣溶液反應;
B.鐵粉過量,反應生成的是亞鐵離子,滴入KSCN溶液后不會變紅;
C.碘化銀更難溶,當c(Cl-)•c(Ag+)>Ksp(AgCl)時會生成沉淀;
D.二氧化硫的溶液呈酸性,酸性條件下硝酸根離子能夠將二氧化硫氧化成硫酸,硫酸與鋇離子反應生成硫酸鋇沉淀.
解答 解:A.將過量的CO2通入CaCl2溶液中,二者不反應,不會生成Ca(HCO3)2,故A錯誤;
B.過量的Fe粉加入HNO3溶液中,充分反應后生成硝酸亞鐵,滴入KSCN溶液后溶液不會變紅,故B錯誤;
C.AgI沉淀中滴入稀KCl溶液,若c(Cl-)•c(Ag+)>Ksp(AgCl),則生成白色沉淀,但AgI比AgCl更難溶,故C錯誤;
D.將SO2通入Ba(NO2)2中,硝酸根離子在酸性條件下具有強氧化性,則二者發生氧化還原反應生成硫酸鋇沉淀,故D正確;
故選D.
點評 本題考查了化學實驗方案的評價,題目難度不大,涉及反應條件應用、常見離子檢驗、難溶物溶解平衡、氧化還原反應等知識,明確常見元素及其化合物性質為解答關鍵,試題培養了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:選擇題
| A. | 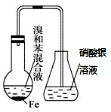 驗證苯和液溴在催化劑作用下發生取代反應 | |
| B. | 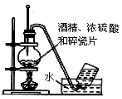 實驗室制備并收集乙烯 | |
| C. | 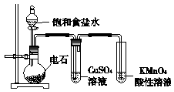 制備乙炔并檢驗其性質 | |
| D. | 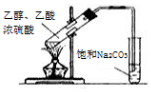 乙醇與乙酸反應制備乙酸乙酯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化鐵能與酸反應,可用于制作紅色涂料 | |
| B. | NaHCO3能與堿反應,可用作焙制糕點的膨松劑 | |
| C. | 銅的金屬活動性比鐵弱,可用銅罐代替鐵罐貯運濃硝酸 | |
| D. | 氫氧化鋁具有弱性,可用于制胃酸中和劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
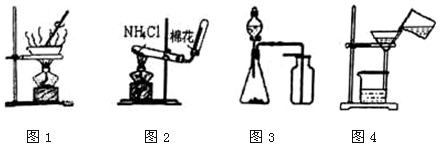
| A. | 用圖1所示裝置進行食鹽溶液的蒸發結晶 | |
| B. | 用圖2所示裝置在實驗室制取少量氨氣 | |
| C. | 用圖3所示裝置制取少量CO2、O2或NO | |
| D. | 用圖4所示裝置進行固液物質的分離 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-8的溶液:K+、Mg2+、C1-、NO3- | |
| B. | 無色透明溶液:Na+、Fe2+、Cl-,SCN- | |
| C. | 中性溶液:K+、A13+、SO42-、S2- | |
| D. | pH=l的溶液:Na+、Fe3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該有機物的分子式為C11H12O3 | |
| B. | 能使酸性KMnO4溶液、溴水褪色,原理相同 | |
| C. | 一定條件下,能發生加聚反應又能發生縮聚反應 | |
| D. | 1mol該有機物能與H2發生反應,消耗H24mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 上述三個反應都是置換反應 | |
| B. | 反應②中還原劑與氧化劑的物質的量之比為6:1 ①中KCl是氧化產物,KBr發生還原反應 | |
| C. | 氧化性由強到弱的順序為:KBrO3>KClO3>Cl2>Br2 | |
| D. | 反應③中1molKBrO3反應,則還原劑得電子的物質的量為5 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 瑪瑙的主要成分是硅酸鹽 | |
| B. | 某濃度的HNO3在反應中不可能被還原成NH3 | |
| C. | 普通水泥是硅酸鹽材料 | |
| D. | 二氧化硅是將太陽能轉換為電能的常用材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2b-3a | B. | 3a-2b | C. | $\frac{1}{3}$(2b-3a) | D. | $\frac{1}{3}$(a-2b) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com