
分析 (1)根據題中信息及及氧化還原反應知識寫出反應方程式:XeF2與水僅發生氧化還原反應為:2XeF2+2H2O→2Xe↑+O2↑+4HF ①
XeF4與水發生氧化還原反應為:3XeF4+6H2O→Xe↑+2XeO3+12HF ②
另一半的XeF4發生歧化反應為:XeF4+2H2O→Xe↑+O2↑+4HF ③
有一半的XeF4與水發生氧化還原反應,另一半的XeF4則發生歧化反應,③×3+②可得XeF4與水反應的總方程式:6XeF4+12H2O→4Xe↑+3O2↑+2XeO3+24HF,
然后分別根據PV=nRT計算出氧氣和總氣體的物質的量,設出XeF2和XeF4的物質的量,再分別根據生成氧氣的物質的量、生成Xe的物質的量列式計算即可;
(2)原溶液中n(SO42-)=n(BaCl2)=0.4L×4mol/L=1.6mol,
假設原溶液中只有CuSO4,由Fe+Cu2+=Cu+Fe2+可知,則參加反應的n(Fe)=n(CuSO4)=1.6mol,反應的鐵粉質量為:1.6mol×56g/mol=89.6g,
假設原溶液中只有Fe2(SO4)3,由Fe+Fe2(SO4)3=3FeSO4可知,則參加反應的n(Fe)=1.6mol×$\frac{1}{3}$,反應的鐵粉質量為:1.6mol×$\frac{1}{3}$×56g/mol=22.9g,
所以21.7g鐵粉會完全反應,沒有剩余,最后得到16.8g殘留固體為銅,
因氧化性Fe3+>Cu2+,則加入鐵粉,先發生Fe+Fe2(SO4)3=3FeSO4,Fe3+反應完畢后發生Fe+CuSO4=FeSO4+Cu,根據方程式計算生成16.8gCu消耗Fe的質量,進而計算與Fe2(SO4)3反應消耗Fe的質量,根據方程式計算n[Fe2(SO4)3],再根據硫酸根守恒計算n(CuSO4),根據c=$\frac{n}{V}$計算硫酸銅溶液的濃度.
解答 解:(1)XeF2與水僅發生氧化還原反應為:2XeF2+2H2O→2Xe↑+O2↑+4HF ①
XeF4與水發生氧化還原反應為:3XeF4+6H2O→Xe↑+2XeO3+12HF ②
XeF4發生歧化反應為:XeF4+2H2O→Xe↑+O2↑+4HF ③
有一半的XeF4與水發生氧化還原反應,另一半的XeF4則發生歧化反應,③×3+②可得XeF4與水反應的總方程式:6XeF4+12H2O→4Xe↑+3O2↑+2XeO3+24HF ④
n(O2)=$\frac{PV({O}_{2})}{RT}$=$\frac{1.00×1{0}^{5}×24.1×1{0}^{-6}}{8.31×290}$=1.00×10-3mol,
n(總)=$\frac{1.00×1{0}^{5}×60.2×1{0}^{-6}}{8.31×290}$=2.50×10-3mol,
則Xe的物質的量為:2.50×10-3mol-1.00×10-3mol=1.50×10-3mol,
設原固體中含有XeF2的物質的量為x、XeF4的物質的量為y,
根據①④可知生成Xe的物質的量可得:n(Xe)=x+$\frac{2}{3}$y=1.50×10-3mol,生成的氧氣為:n(O2)=$\frac{x}{2}$+$\frac{y}{2}$=1.00×10-3mol,
二者聯立解得:x=0.500×10-3mol、y=1.50×10-3mol,
所以原固體混合物中XeF4的物質的量分數是:$\frac{1.5×1{0}^{-3}mol}{1.5×1{0}^{-3}mol+0.50×1{0}^{-3}mol}$=0.25,
則原固體混合物中XeF2的物質的量分數是:1-0.25=0.75,
故答案為:0.25或25%;
(2)原溶液中n(SO42-)=n(BaCl2)=0.4L×4mol/L=1.6mol,
假設原溶液中只有CuSO4,由Fe+Cu2+=Cu+Fe2+可知,則參加反應的n(Fe)=n(CuSO4)=1.6mol,反應的鐵粉質量為:1.6mol×56g/mol=89.6g,
假設原溶液中只有Fe2(SO4)3,由Fe+Fe2(SO4)3=3FeSO4可知,則參加反應的n(Fe)=1.6mol×$\frac{1}{3}$,反應的鐵粉質量為:1.6mol×$\frac{1}{3}$×56g/mol=22.9g,
所以21.7g鐵粉會完全反應,沒有剩余,最后得到16.8g殘留固體為銅,
Fe+CuSO4=FeSO4+Cu
56 64
m(Fe) 16.8g
m(Fe)=$\frac{16.8g×56}{64}$=14.7g
與Fe2(SO4)3反應的鐵粉質量為:21.7g-14.7g=7g,
Fe+Fe2(SO4)3=3FeSO4
56g 1mol
7g n[Fe2(SO4)3]
所以 n[Fe2(SO4)3]=$\frac{7g×1mol}{56}$=0.125mol,
根據硫酸根守恒,則n(CuSO4)=1.6mol-0.125mol×3=1.225mol,
則c(CuSO4)=$\frac{1.225mol}{0.5L}$=2.45mol/L,
故答案為:2.45.
點評 本題考查了混合物反應的計算,題目難度較大,難點、易錯點為(1),根據題中信息正確書寫出反應的化學方程式為解答關鍵,試題側重考查學生的分析、理解能力及化學計算能力.


 全優點練單元計劃系列答案
全優點練單元計劃系列答案科目:高中化學 來源: 題型:選擇題
| A. | 用傾析法分離時,將燒杯中的上層清液用玻璃棒引流到另一容器內,即可使沉淀與清液分離 | |
| B. | 洗滌沉淀時,應在過濾器中加入洗滌液浸沒沉淀,過濾,并重復2到3次 | |
| C. | 抽濾完畢,應先拆下連接抽氣泵和吸濾瓶的橡膠管,再關閉水龍頭,最后將濾液從吸濾瓶支管口倒出 | |
| D. | 用移液管取液后,將移液管垂直放入稍傾斜的容器中,并使管尖與容器內壁接觸,松開食指使溶液全部流出,數秒后,取出移液管 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,B
,B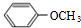 ,C
,C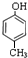 .
. ,②
,②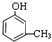 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知A、B、C、D、E都是元素周期表中前四周期的元素,它們的核電荷數A<B<C<D<E.B原子的p軌道半充滿,形成的氫化物的沸點是同主族元素的氫化物中最低的.D原子得到一個電子后3p軌道全充滿.A+比D原子形成的離子少一個電子層.C與A形成A2C型離子化合物.E的原子序數為26,E原子或離子外圍有較多能量相近的空軌道而能與一些分子或離子形成配合物.請根據以上情況,回答下列問題:(答題時,A、B、C、D、E用所對應的元素符號表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它們的核電荷數A<B<C<D<E.B原子的p軌道半充滿,形成的氫化物的沸點是同主族元素的氫化物中最低的.D原子得到一個電子后3p軌道全充滿.A+比D原子形成的離子少一個電子層.C與A形成A2C型離子化合物.E的原子序數為26,E原子或離子外圍有較多能量相近的空軌道而能與一些分子或離子形成配合物.請根據以上情況,回答下列問題:(答題時,A、B、C、D、E用所對應的元素符號表示) .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
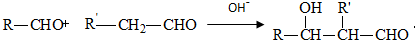 .有機物G(C20H18O4)是一種酯,合成路線如下:
.有機物G(C20H18O4)是一種酯,合成路線如下: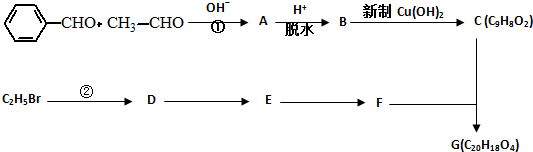
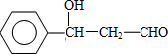 ;F的結構簡式:CH2OHCH2OH;
;F的結構簡式:CH2OHCH2OH; .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHSO3溶液中投入過氧化鈉粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | ||||||||
| B. | AlCl3溶液與燒堿溶液反應,當 n(OH-):n(Al3+ )=7:2時:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | ||||||||
| C. | 鈉與CuSO4溶液反應,2Na+Cu2+═Cu↓+2Na+ | ||||||||
| D. | 已知碳酸和次氯酸的電離平衡常數如下:
|
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若降低溫度,可以加快反應速率 | |
| B. | 使用催化劑是為了加快反應速率 | |
| C. | 在上述條件下,N2的轉化率能達到100% | |
| D. | 達到平衡時,N2、H2和NH3的濃度一定相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com