
 向100mL 3mol/L的NaOH溶液中緩慢通入一定量的CO2,充分反應,測得最后溶液的PH>7.
向100mL 3mol/L的NaOH溶液中緩慢通入一定量的CO2,充分反應,測得最后溶液的PH>7.分析 (1)CO2與NaOH反應可生成Na2CO3或NaHCO3,二者溶液都呈堿性;如果是多種成分,可能是二者混合物,也可能NaOH有剩余;
(2)①加入鹽酸200mL時開始生成氣體,當加入鹽酸300mL時不再產生氣體,A→C段發生
NaHCO3+HCl═NaCl+H2O+CO2↑,而O→A段消耗的鹽酸為A→B消耗的鹽酸的二倍,應為NaOH和Na2CO3的混合物,都可與鹽酸反應,據此寫出反應的離子方程式;AB段碳酸氫根離子與氯化氫反應生成二氧化碳氣體;
②根據AB段消耗氯化氫溶液的體積及氯化氫的濃度計算出生成二氧化碳的物質的量及標況下的體積;
③AB段發生反應為NaHCO3+HCl═NaCl+H2O+CO2↑,根據氫氧化鈉的物質的量計算出溶質氯化鈉的濃度.
解答 解:(1)CO2與NaOH反應可生成Na2CO3或NaHCO3,二者溶液都呈堿性,則如果是單一成分,可能是
Na2CO3或NaHCO3,如果是多種成分,若1<$\frac{n(NaOH)}{n(CO2)}$<2,溶質是NaHCO3、Na2CO3.若$\frac{(NaOH)}{n(CO2)}$>2,溶質是Na2CO3、NaOH,
故答案為:Na2CO3或NaHCO3;NaOH和Na2CO3或Na2CO3和NaHCO3;
(2)①加入鹽酸200mL時開始生成氣體,當加入鹽酸300mL時不再產生氣體,A→C段發生NaHCO3+HCl═NaCl+H2O+CO2↑,而O-A段消耗的鹽酸為A→B的二倍,反應產物應為NaOH和Na2CO3的混合物,二者都可與鹽酸反應,反應的離子方程式分別為:OH-+H+═H2O、CO32-+H+═HCO3-;
故答案為:OH-+H+═H2O;CO32-+H+═HCO3-;
②根據反應方程式CO32-+H+═HCO3-、HCO3-+H+=CO2↑+H2O可知,碳酸鈉消耗鹽酸的體積為100mL,則氫氧化鈉消耗的鹽酸體積也是100mL,即Na2CO3與NaOH的物質的量相等,根據鈉離子守恒,則碳酸鈉的物質的量為:$\frac{1}{3}$×(3mol/L×0.1L)=0.1mol,根據碳原子守恒,反應生成二氧化碳的物質的量為0.1mol,標況下0.1mol二氧化碳的體積為:22.4L/mol×0.1mol=2.24L=2240mL,
故答案為:2240;
③B點時溶質為氯化鈉,根據氫氧化鈉的物質的量可知NaCl的物質的量為:0.1L×3mol/L=0.3mol,
則NaCl的物質的量濃度是:$\frac{0.3mol}{0.3+0.1L}$=0.75mol/L,
故答案為:0.75.
點評 本題考查混合物的計算,題目難度中等,注意從圖象分析反應可能的情況進行判斷和計算,本題關鍵是根據圖象判斷溶液溶質的成分,注意在計算過程中守恒思想的應用.


科目:高中化學 來源: 題型:選擇題
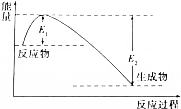 如圖所示的是1molNO2和足量的CO完全反應生成CO2和NO過程中的能量變化示意圖,能夠表示出CO2+NO=NO2+CO的能量變化示意圖的是( )
如圖所示的是1molNO2和足量的CO完全反應生成CO2和NO過程中的能量變化示意圖,能夠表示出CO2+NO=NO2+CO的能量變化示意圖的是( )| A. | 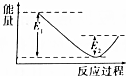 | B. | 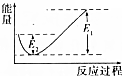 | C. | 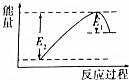 | D. | 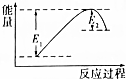 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
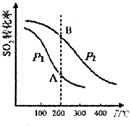 研究硫酸工業原理及含硫化合物的性質具有重要意義.
研究硫酸工業原理及含硫化合物的性質具有重要意義.| 氣體 | SO2 | O2 | SO3 |
| 濃度(mol•L-1) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,則反應物總能量>生成物總能量 | |
| B. | 相同條件下,如果1 mol氫原子所具有的能量為E1,1 mol氫分子所具有的能量為E2,則2E1=E2 | |
| C. | 101 kPa時,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,則H2的燃燒熱為571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,則含1 mol NaOH的氫氧化鈉固體與含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | +184.6KJ•mol-1 | B. | 92.3KJ•mol-1 | C. | -369.2KJ•mol-1 | D. | +92.3KJ•mol-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com