
m g H2和n g He的下列說法中,正確的是
A.同溫同壓下,H2與He的體積比為m∶2n
B.同溫同壓下,若m=n,則H2與He的分子數之比為2∶1
C.同溫同壓下,同體積時,H2與He的質量比m/n>1
D.同溫同壓下,H2與He的密度比為2∶1
科目:高中化學 來源: 題型:
下列說法或計算正確的是 ( )
A、采用加熱蒸發溶劑的方法可以使濃度為2mol/L的氫溴酸溶液的濃度變為4mol/L
B、m g H2和n g He,在同溫同壓下密度之比等于m:n
C、只有標準狀況下,等物質的量的乙烯和一氧化碳所含的分子數才相等
D、將a%的某物質的水溶液加熱蒸發掉m g水(溶質不揮發,且蒸發過程中無溶質析出),所得溶液體積為V L,溶質的質量分數為蒸發前的2倍.設溶質的相對分子質量為M,則蒸發后所得溶液的物質的量濃度為![]()
查看答案和解析>>
科目:高中化學 來源:2010-2011學年東北師大附中、哈師大附中,遼寧實驗中學三校高三第二次聯合模擬考試(理綜 題型:填空題
X、Y為兩種主族元素,原子序數X小于Y,它們與元素Se三種元素原子序數之和為56。已知:X有兩種氧化物M和N。Y與Se是相鄰周期同主族元素,其中Se可以從電解精煉銅的陽極泥中獲得。從陽極泥中提取Se的流程如下:
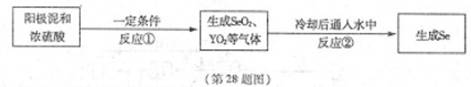
回答下列問題:(各元素用相應的元素符號表示)
(1)寫出X和Y形成的化合物的電子式 。
(2)陽極泥中Se以單質、Ag2Se、Cu2Se等形式存在。寫出①中Se單質與濃硫酸反應的化學方程式 。
(3)寫出反應②的化學方程式為 。
(4)某溫度下在容積固定的密閉容器中,下列反應達到平衡:M(g)+H2O(g)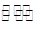 N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
M轉化率 |
H2O轉化率 |
|
1:1 |
0.5 |
0.5 |
|
1:2 |
0.67 |
0.335 |
|
1:3 |
0.75 |
0.25 |
①已知M和H2的燃燒熱分別為283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=—44kJ/mol,
寫出上述反應的熱化學方程式 。
②該反應的平衡常數為 。該溫度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,則起始時該反應速率V正 V逆(填“>”、“<”或“=”)
③結合表中數據判斷下列說法中正確的是
A.增加H2O(g)的量,M的轉化率升高而H2O(g)的轉化率降低
B.若M與H2O(g)的轉化率相同時,二者的初始投入量一定相同
C.M和H2O(g)初始物質的量之比等于二者轉化率之比
D.當M與H2O(g)物質的之比為1:4時,M的轉化率為0.85
查看答案和解析>>
科目:高中化學 來源: 題型:
X、Y為兩種主族元素,原子序數X小于Y,它們與元素Se三種元素原子序數之和為56。已知:X有兩種氧化物M和N。Y與Se是相鄰周期同主族元素,其中Se可以從電解精煉銅的陽極泥中獲得。從陽極泥中提取Se的流程如下:
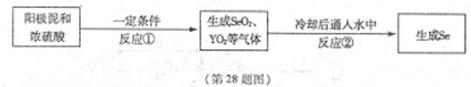
回答下列問題:(各元素用相應的元素符號表示)
(1)寫出X和Y形成的化合物的電子式 。
(2)陽極泥中Se以單質、Ag2Se、Cu2Se等形式存在。寫出①中Se單質與濃硫酸反應的化學方程式 。
(3)寫出反應②的化學方程式為 。
(4)某溫度下在容積固定的密閉容器中,下列反應達到平衡:M(g)+H2O(g)![]() N(g)+H2(g)
N(g)+H2(g)
| n(M):n(H2O) | M轉化率 | H2O轉化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
①已知M和H2的燃燒熱分別為283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=—44kJ/mol,
寫出上述反應的熱化學方程式 。
②該反應的平衡常數為 。該溫度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,則起始時該反應速率V正 V逆(填“>”、“<”或“=”)
③結合表中數據判斷下列說法中正確的是
A.增加H2O(g)的量,M的轉化率升高而H2O(g)的轉化率降低
B.若M與H2O(g)的轉化率相同時,二者的初始投入量一定相同
C.M和H2O(g)初始物質的量之比等于二者轉化率之比
D.當M與H2O(g)物質的之比為1:4時,M的轉化率為0.85
查看答案和解析>>
科目:高中化學 來源: 題型:
X、Y為兩種主族元素,原子序數X小于Y,它們與元素Se三種元素原子序數之和為56。已知:X有兩種氧化物M和N。Y與Se是相鄰周期同主族元素,其中Se可以從電解精煉銅的陽極泥中獲得。從陽極泥中提取Se的流程如下:
回答下列問題:(各元素用相應的元素符號表示)
(1)寫出X和Y形成的化合物的電子式 。
(2)陽極泥中Se以單質、Ag2Se、Cu2Se等形式存在。寫出①中Se單質與濃硫酸反應的化學方程式 。
(3)寫出反應②的化學方程式為 。
(4)某溫度下在容積固定的密閉容器中,下列反應達到平衡:M(g)+H2O(g)N(g)+H2(g)
| n(M):n(H2O) | M轉化率 | H2O轉化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
①已知M和H2的燃燒熱分別為283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=—44kJ/mol,
寫出上述反應的熱化學方程式 。
②該反應的平衡常數為 。該溫度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,則起始時該反應速率V正 V逆(填“>”、“<”或“=”)
③結合表中數據判斷下列說法中正確的是
A.增加H2O(g)的量,M的轉化率升高而H2O(g)的轉化率降低
B.若M與H2O(g)的轉化率相同時,二者的初始投入量一定相同
C.M和H2O(g)初始物質的量之比等于二者轉化率之比
D.當M與H2O(g)物質的之比為1:4時,M的轉化率為0.85
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com