
【題目】隨原子序數遞增,八種短周期元素(用字母x等表示)原子半徑的相對大小、最高正價或最低負價的變化如圖所示。

根據判斷出的元素回答問題:
(1)X的原子結構示意圖為 ______________。
(2)比較d、e常見離子的半徑大小(用化學式表示,下同):______> ;比較g、h的最高價氧化物對應水化物的酸性強弱: >_______。
(3)任選上述元素組成一種四原子共價化合物,寫出其電子式:_____________。
【答案】 ![]() r(O2-) > r(Na+) HClO4 > H2SO4
r(O2-) > r(Na+) HClO4 > H2SO4 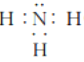 (或
(或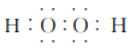 或
或![]() )
)
【解析】8種元素為短周期元素,在同一周期中,從左向右原子半徑逐漸變小,同一主族,從上到下原子半徑逐漸變小,主族元素最高正化合價一般等于族序數,最低負價=8-主族族序數,從圖中的化合價、原子半徑的大小及原子序數,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素;根據以上分析解答。
(1)X是H元素,核電荷數為1, 原子結構示意圖為 ![]() ;正確答案:
;正確答案:![]() 。
。
(2)電子層結構相同的離子,核電荷數越大離子半徑越小,故離子半徑:r(O2-)>r(Na+);非金屬性越強,最高價氧化物水化物的酸性越強,故酸性:HClO4>H2SO4;正確答案:r(O2-) > r(Na+) ; HClO4 > H2SO4 。
(3)四原子共價化合物,可以是NH3、H2O2、C2H2等,其電子式為: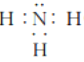 (或
(或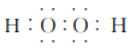
![]() 等);正確答案:
等);正確答案: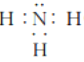 (或
(或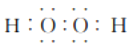 或
或![]() )。
)。


科目:高中化學 來源: 題型:
【題目】四個課外活動小組為完成實驗目的,均設計了兩套實驗裝置(部分圖中的夾持裝置略去),其中一個活動小組設計的兩套裝置中,有一套裝置存在原理錯誤,該活動小組是
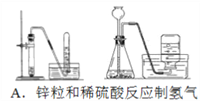
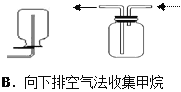
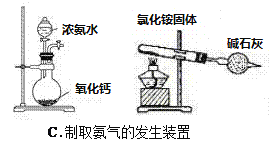
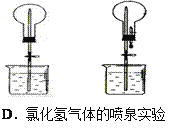
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列裝置應用于實驗室進行相關實驗,能達到實驗目的是( ) 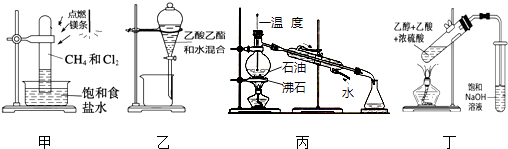
A.用裝置甲在強光照條件下制取一氯甲烷
B.用裝置乙分離乙酸乙酯和水
C.用裝置丙蒸餾石油并收集60~150℃餾分
D.用裝置丁制取并收集乙酸乙酯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】PASNa(二水合對氨基水楊酸鈉)是抗結核藥,其結構簡式如圖化合物1所示,下列說法正確的是( ) 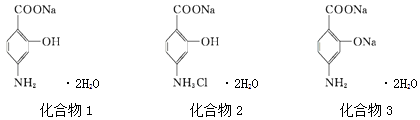
A.化合物1和化合物2均能使酸性KMnO4溶液褪色
B.化合物1的核磁共振氫譜測出5個譜峰
C.PASNa與足量鹽酸反應生成如上圖化合物2
D.通入足量CO2能將圖化合物3轉化為PASNa
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、X是中學化學常見的物質,A、B、C均由短周期元素組成,轉化關系如圖。
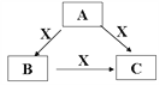
請針對以下三種不同情況回答:
(1)若A、B、C中均含同一種常見金屬元素,該元素在C中以陰離子形式存在,向C的水溶液中通入過量的CO2可得B的白色膠狀沉淀。
①A中含有的金屬元素為_________(寫元素名稱),它在周期表中的位置為_____________。
②寫出B → C反應的離子方程式為___________________________________。
(2)若A為稀HNO3,X為常見黑色金屬單質,寫出A→B反應的離子方程式__________。
(3)若A、B、C三種化合物的焰色反應均呈黃色,水溶液均為堿性;將C加到鹽酸中,有無色無味的氣體X產生。
①A中所含有的化學鍵是________________
②自然界中存在B、C和H2O按一定比例結晶而成的固體,取一定量該固體溶于水配成一定物質的量濃度的溶液100mL,所用到的玻璃儀器有玻璃棒、燒杯、________、_________。
③若測得上述溶液中金屬陽離子的濃度為0.5mol/L。若取相同質量的固體加熱至恒重,剩余固體的質量為 ____________ g 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用工業冶煉硫酸銅(含有Fe2+、AsO2-、Ca2+等雜質)提純制備電鍍硫酸銅的生產流程如下:

已知:①Fe3+、Cu2+開始沉淀的pH分別2.7、5.4,完全沉淀的pH分別為3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含銅32 g·L-1的硫酸銅溶液1.0 L,需要稱量冶煉級硫酸銅的質量至少為___________g。
(2)測定溶解液中的Fe2+的濃度,可用KMnO4標準溶液滴定,取用KMnO4溶液應使用
________(“酸式”或“堿式”)滴定管,其中反應離子方程式為:______________________。若要檢驗調節pH后溶液中的Fe3+已除盡的方法是___________________________。
(3)氧化后需要將溶液進行稀釋及調節溶液的pH=5,則稀釋后的溶液中銅離子濃度最大不能超過____________mol·L-1。
(4)固體Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外還有__________________,由溶液Ⅰ獲得CuSO4·H2O,需要經過________ 、____________、過濾、洗滌、干燥操作。
(5)利用以上電鍍級硫酸銅作為電解質溶液,電解粗銅(含鋅、銀、鉑雜質)制備純銅,寫出陽極發生的電極反應式:________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com