
 同溫同壓下,在甲、乙兩個等體積的干燥圓底燒瓶中分別充滿NH3、NO2 進行噴泉實驗.如圖:
同溫同壓下,在甲、乙兩個等體積的干燥圓底燒瓶中分別充滿NH3、NO2 進行噴泉實驗.如圖: CaCl2+2 NH3↑+2H2O,
CaCl2+2 NH3↑+2H2O, CaCl2+2 NH3↑+2H2O;
CaCl2+2 NH3↑+2H2O;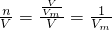 知,溶液的物質的量濃度與氣體摩爾體積有關,與氣體的體積無關,所以相同條件下,兩種溶液的物質的量濃度相等.
知,溶液的物質的量濃度與氣體摩爾體積有關,與氣體的體積無關,所以相同條件下,兩種溶液的物質的量濃度相等.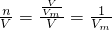 計算氨水的物質的量濃度.
計算氨水的物質的量濃度.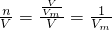 ,得出物質的量濃度與氣體的體積無關,只與氣體摩爾體積有關,即可解答本題.
,得出物質的量濃度與氣體的體積無關,只與氣體摩爾體積有關,即可解答本題. 

 輕松課堂單元期中期末專題沖刺100分系列答案
輕松課堂單元期中期末專題沖刺100分系列答案科目:高中化學 來源: 題型:
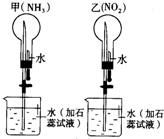 同溫同壓下,在甲、乙兩個等體積的干燥圓底燒瓶中分別充滿NH3、NO2 進行噴泉實驗.如圖:
同溫同壓下,在甲、乙兩個等體積的干燥圓底燒瓶中分別充滿NH3、NO2 進行噴泉實驗.如圖:
| ||
| ||
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題

查看答案和解析>>
科目:高中化學 來源:2009-2010學年重慶市第二外國語學校高二(上)期中化學試卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com