
Ⅰ.請回答:
(1)Na2O2的電子式 。
(2)除去FeCl3中少量FeCl2,除雜過程涉及的化學反應方程式 。
(3)往飽和Na2CO3溶液中通入CO2氣體,溶液中出現白色渾濁,寫出該反應的離子方程式 。
(4)雙氧水能使酸性高錳酸鉀溶液褪色,請完成以下相關反應的離子方程式:
( )MnO4-+( )H2O2+ =( )Mn2++( )H2O+ 。
Ⅱ.無機化合物A 和NaH都是重要的還原劑,遇水都強烈反應。一定條件下,2.40g NaH與氣體B反應生成3.90g化合物A和 2.24L(已折算成標準狀況)的H2。已知氣體B可使濕潤紅色石蕊試紙變藍。已知:NH3+ NH3=NH4++NH2-
請回答下列問題:
(1)A的化學式是 。
(2)A與足量鹽酸發生非氧化還原反應的化學方程式 。
(3)在高溫下氫化鈉(NaH)可將四氯化鈦(TiC14)還原成金屬鈦,該反應的化學方程式為 。
科目:高中化學 來源:2016-2017學年天津市武清區等五區縣高二上期中化學卷(解析版) 題型:選擇題
在25℃的純水中通入一定量的氯化氫,當溶液的pH=1時,則由水電離出的c(H+)是
A.1×10-1mol/L B.1×10-6mol/L C.1×10-3mol/L D.1×10-13mol/L
查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市河東區高二上學期期中質檢化學試卷(解析版) 題型:填空題
在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持溫度恒定,發生反應:SO2(g)+ NO2(g) SO3(g)+NO(g)。當達到平衡狀態時,測得容器中SO2(g)的轉化率為50%。
SO3(g)+NO(g)。當達到平衡狀態時,測得容器中SO2(g)的轉化率為50%。
試求:該溫度下、該容器中,再繼續加入1mol的SO2(g),則:
(1)化學平衡將向________方向移動,NO2的轉化率將____________(填“增大” 、“不變”或“減小”);
(2)經計算,當達到新的平衡狀態時,容器中SO2(g)的濃度是___________mol/L;
(3)整個過程中,SO2的轉化率由50%變為___________%,NO2的轉化率由__________%變為___________%。
(4)計算結果給我們的啟示是:增大一種反應物物的用量,其轉化率將_______________(填“增大” 、“不變”或“減小”)另一反應物的轉化率將____________(填“增大” 、“不變”或“減小”)。現實生產中的意義是:可以通過增大________的用量,來提高成本高的反應物的利用率。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市河東區高二上學期期中質檢化學試卷(解析版) 題型:選擇題
已知熱化學方程式:SO2(g)+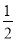 O2(g)
O2(g) SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反應,最終放出的熱量為
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反應,最終放出的熱量為
A.98.32kJ B.196.64kJ/mol C.<196.64kJ D.>196.64kJ
查看答案和解析>>
科目:高中化學 來源:2017屆吉林省高三上11月模擬化學卷(解析版) 題型:選擇題
下圖是利用鈦白粉(TiO2)生產海綿鈦(Ti)的一種工藝流程:
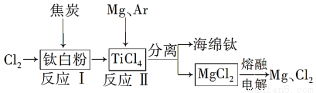
有關說法正確的是( )
A.反應Ⅰ中鈦白粉做氧化劑
B.該工藝中可以循環使用的物質只有Cl2
C.可以用N2代替Ar作為反應Ⅱ中的保護氣
D.反應Ⅱ的化學方程式為2Mg+TiCl4 2MgCl2+Ti
2MgCl2+Ti
查看答案和解析>>
科目:高中化學 來源:2017屆貴州省高三上月考三化學試卷(解析版) 題型:選擇題
下列各組在溶液中的反應,不管反應物的量是多少,都能用同一離子方程式表示的是(  )
)
A.FeBr2與Cl2 B.Ba(OH)2與H2SO4
C.HCl與Na2CO3 D.NaHCO3與Ca(OH)2
查看答案和解析>>
科目:高中化學 來源:2016屆內蒙古高三上學期期中化學試卷(解析版) 題型:填空題
亞硝酸(HNO2)是一種與醋酸酸性相當的弱酸,很不穩定,通常在室溫下立即分解。
(1)在酸性條件下,當NaNO2與KI按物質的量1:1恰好完全反應,且I- 被氧化為I2時,產物中含氮的物質為____________(填化學式)。
(2)要得到穩定HNO2溶液,可以往冷凍的濃NaNO2溶液中加入或通入某種物質,下列物質不適合使用是___________(填序號)。
a. 稀硫酸 b. 二氧化碳 c.二氧化硫 d.磷酸
(3)工業廢水中的NO2- 可用鋁粉除去。已知此反應體系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六種物質。將氧化劑和還原劑的化學式及其配平后的系數填入下列方框中:
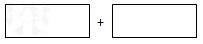
(4)改用電解法將廢水中NO2- 轉換為N2除去,N2 將在___________(填電極名稱)生成
將在___________(填電極名稱)生成
查看答案和解析>>
科目:高中化學 來源:2016-2017學年浙江省高二上期中化學卷(解析版) 題型:填空題
常溫下有0.1 mol·L-1四種溶液NaOH、 NH3·H2O、 HCl 、CH3COOH
(1)已知CH3COOH溶液的pH=3,其電離度為 ,由水電離的c(H+)= mol·L-1。
(2)相同pH的CH3COOH溶液和HCl溶液加水稀釋,其pH變化情況如圖,其中表示HCl溶液的是曲線 ,a、b兩點中,導電能力更強的是 。
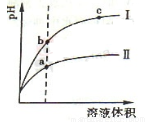
(3)NH3·H2O溶液和HCl溶液混合,已知體積V(NH3·H2O)> V(HCl),當溶液中c(NH3·H2O)= c(NH4+)時,溶液的pH= 。[已知:Kb(NH3·H2O)=1.77×10-5,lg 1.77=0.25]
查看答案和解析>>
科目:高中化學 來源:2016-2017學年云南省高二上期中化學卷(解析版) 題型:選擇題
在體積固定的密閉容器中,加入2molA和1molB發生下列反應并且達到化學平衡狀態,2A(g)+B(g)  3C(g)+D(g),平衡時C的濃度為amol·L-1。若維持容器體積和溫度不變,按下列4種方法配比作為起始物質充入該容器中,達到平衡后,C的濃度仍為amol·L-1的是( )
3C(g)+D(g),平衡時C的濃度為amol·L-1。若維持容器體積和溫度不變,按下列4種方法配比作為起始物質充入該容器中,達到平衡后,C的濃度仍為amol·L-1的是( )
A.4molA+2molB B.3molC+1molB+1molD+1molA
C.2molA+1molB+1molD D.1molA+0.5molB + 1.5molC+0.5molD
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com