
(10分)電浮選凝聚法是工業上采用的一種污水處理方法:保持污水的pH在5.0~6.0之間,通過電解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉積下來,具有凈化水的作用。陰極產生的氣泡把污水中懸浮物帶到水面形成浮渣層,除去浮渣層,即起到了浮選凈化的作用。某科研小組用電浮選凝聚法處理污水,設計裝置示意圖,如圖所示。
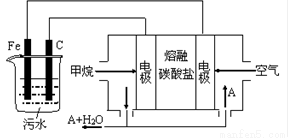
(1)實驗時若污水中離子濃度較小,導電能力較差,產生氣泡速率緩慢,無法使懸浮物形成浮渣。此 時,可向污水中加入適量的 。
a.BaSO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)電解池陽極發生了兩個電極反應,其中一個反應生成一種無色氣體,則陽極的電極反應式分別是
①.______________________;②. 。
(3)電極反應①和②的生成物反應得到Fe(OH)3沉淀的離子方程式是____________________。
(4)該燃料電池是以熔融碳酸鹽為電解質,CH4為燃料,空氣為氧化劑,稀土金屬材料作電極。為了使該燃料電池長時間穩定運行,電池的電解質組成應保持穩定,電池工作時必須有部分A物質參加循環(如圖)。A物質的化學式是____________________。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016屆吉林省長春市高三上學期期中測試化學試卷(解析版) 題型:填空題
(13分)甲醇是一種可再生能源,具有開發和應用的廣闊前景,請回答下列問題:
(1)一定溫度下,在一恒容的密閉容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能說明該反應已達到平衡狀態的是 (填序號)
A.每消耗1mol CO的同時生成2molH2
B.混合氣體總物質的量不變
C.生成CH3OH的速率與消耗CO的速率相等
D.CH3OH、CO、H2的濃度都不再發生變化
②CO的平衡轉化率(α)與溫度、壓強的關系如下圖所示。
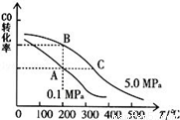
B、C兩點的平衡常數K(B) K(C)(填“>”、“=”或“<”).
③某溫度下,將2.0mol CO和6.0molH2充入2L的密閉容器中,達到平衡時測得c(CO)=0.25mol/L,CO的轉化率= ,此溫度下的平衡常數K= (保留二位有效數字)
(2)常溫下,將V mL、0.20mol/L氫氧化鈉溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反應,溶液pH=7,此時V 20.00(填“>”、“=”或“<”);當氫氧化鈉溶液與甲酸溶液恰好完全反應時,溶液中所含離子濃度由大到小順序__ _____
(3)溫度650℃的熔融鹽燃料電池,用(CO、H2)作反應物,空氣與CO2的混合氣體為正極反應物,鎳作電極,用Li2CO3和Na2CO3混合物作電解質.該電池的正極反應式為
(4)己知:CH3OH、H2的燃燒熱(△H)分別為﹣726.5kJ/mol、﹣285.8kJ/mol,則常溫下CO2和H2反應生成CH3OH和H2O的熱化學方程式是
查看答案和解析>>
科目:高中化學 來源:2015-2016學年甘肅蘭州一中高二上期中測試文科化學試卷(解析版) 題型:選擇題
化學反應C(s)+H2O(g)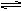 CO(g)+H2(g),△H>0,達到平衡,下列敘述中正確的是
CO(g)+H2(g),△H>0,達到平衡,下列敘述中正確的是
(A)擴大容器的容積,平衡向正反應方向移動
(B)升高溫度,正反應速率增大,逆反應速率減小,平衡向正反應方向移動
(C)加入水蒸氣使容器壓強增大,平衡向逆反應方向移動
(D)加入固體碳,平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源:2014-2015學年山東省濟南外國語學校高三上學期期中測試化學試卷(解析版) 題型:選擇題
下列有關pH變化判斷中,正確的是
A.隨著溫度的升高,Na2CO3溶液pH減小
B.隨著溫度的升高,純水的pH增大
C.新制氯水經光照一段時間后,溶液pH減小
D.氫氧化鈉溶液久置于空氣中,溶液pH增大
查看答案和解析>>
科目:高中化學 來源:2016屆山東省南校區高三上學期10月階段測化學試卷(解析版) 題型:選擇題
25 ℃下,0.1 mol/L的Na2S溶液,下列敘述正確的是
A.升高溫度,溶液的pH降低
B.加入NaOH固體,溶液中的c(Na+)、c(S2-)均增大
C.c(Na+)>c(S2-)>c(H+)>c(OH-)
D.2c(Na+)=c(S2-)+c(HS-)+c(H2S)
查看答案和解析>>
科目:高中化學 來源:2016屆山東省高三上10月階段質檢化學試卷(解析版) 題型:選擇題
下列說法中正確的是
A.KClO3和SO3溶于水后能導電,故KClO3和SO3為電解質
B.升高溫度能降低反應活化能,所以反應速率加快
C.中和熱測定實驗中需要用到的玻璃儀器有燒杯、溫度計和環形玻璃棒攪拌棒三種
D.等量的CH4在氧氣中燃燒放出的熱量與形成燃料電池放出的熱量一樣多
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧實驗中學高一上10月階段測化學試卷(解析版) 題型:選擇題
要盡量除去雜質,加入的試劑必須稍過量,最后的過量物可以使用物理或化學方法除去。現要除去NaCl中少量的CaCl2、ZnCl2、Na2SO4雜質,下列選用試劑及使用順序正確的是
A.Na2CO3、BaCl2、HCl B.BaCl2、Na2CO3、H2SO4
C.BaCl2、Na2CO3、HCl D.Ba(NO3)2 、Na2CO3、HCl
查看答案和解析>>
科目:高中化學 來源:2015-2016學年內蒙古巴彥淖爾高二上10月月考化學試卷(解析版) 題型:選擇題
已知在同一溫度下列反應的平衡常數:H2(g)+S(s)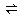 H2S(g),K1 ; S(s)+ O2(g)
H2S(g),K1 ; S(s)+ O2(g)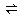 SO2(g),K2 ;則該溫度時反應H2(g)+ SO2(g)
SO2(g),K2 ;則該溫度時反應H2(g)+ SO2(g)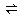 O2(g)+H2S(g)的平衡常數是
O2(g)+H2S(g)的平衡常數是
A.K1 +K2 B.K1-K2 C.K1×K2 D.K1/K2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com