
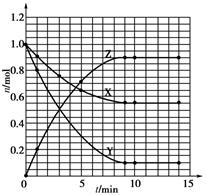
(9分)某溫度時,在2 L密閉容器中氣態(tài)物質(zhì)X和Y反應(yīng)生成氣態(tài)物質(zhì)Z,它們的物質(zhì)的量隨時間的變化如下表所示。

(1)根據(jù)下表中數(shù)據(jù),在下圖中畫出X、Y、Z的物質(zhì)的量(n)隨時間(t)變化的曲線:
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
(2)體系中發(fā)生反應(yīng)的化學方程式是___________________________________________;
(3)列式計算該反應(yīng)在0~3 min時間內(nèi)產(chǎn)物Z的平均反應(yīng)速率:___________________;
(4)該反應(yīng)達到平衡時反應(yīng)物X的轉(zhuǎn)化率α等于 ;
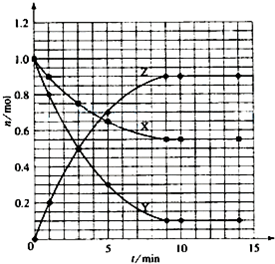
(5)如果該反應(yīng)是放熱反應(yīng)。改變實驗條件(溫度、壓強、催化劑)得到Z隨時間變化的曲線1、2、3(如下圖所示)則曲線1、2、3所對應(yīng)的實驗條件改變分別是:1______________,2______________,3______________。

 (1)
(1) (2)X+2Y
(2)X+2Y 2Z
2Z
(3)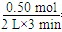 =0.083
mol·L-1·min-1
(4)45% (5)升高溫度
加入催化劑 增大壓強
=0.083
mol·L-1·min-1
(4)45% (5)升高溫度
加入催化劑 增大壓強
 【解析】本題考查化學反應(yīng)速率和化學平衡的綜合運用,圖像識別和有關(guān)計算。
【解析】本題考查化學反應(yīng)速率和化學平衡的綜合運用,圖像識別和有關(guān)計算。
 (1)根據(jù)題目中表格給出的數(shù)據(jù),在坐標系中找出相應(yīng)的點,然后用光滑的曲線描點即可。
(1)根據(jù)題目中表格給出的數(shù)據(jù),在坐標系中找出相應(yīng)的點,然后用光滑的曲線描點即可。
(2)考查可逆反應(yīng)的有關(guān)計算,一般采用三段式計算,即
 aX + bY
aX + bY cZ
cZ
起始量(mol) 1.00 1.00 0
 轉(zhuǎn)化量(mol)
0.45 0.9 0.9
轉(zhuǎn)化量(mol)
0.45 0.9 0.9
平衡量(mol) 0.55 0.1 0.9
 根據(jù)各物質(zhì)的物質(zhì)的量的變化量之比是相應(yīng)的化學計量數(shù)之比可知,體系中發(fā)生反應(yīng)的化學方程式是: X+2Y
根據(jù)各物質(zhì)的物質(zhì)的量的變化量之比是相應(yīng)的化學計量數(shù)之比可知,體系中發(fā)生反應(yīng)的化學方程式是: X+2Y 2Z。
2Z。
(3)根據(jù)圖像可知在3min時,生成物Z的物質(zhì)的量為0.5mol,其平均速率為
0.083mol/L·min。
 (4)平衡時X的物質(zhì)的量是0.55mol,消耗X是0.45mol,所以X的轉(zhuǎn)化率等于0.45mol÷1.00mol×100%=45%。
(4)平衡時X的物質(zhì)的量是0.55mol,消耗X是0.45mol,所以X的轉(zhuǎn)化率等于0.45mol÷1.00mol×100%=45%。
(5)由題目所給圖象可知,在1中,平衡時Z的物質(zhì)的量小于原平衡的物質(zhì)的量,說明平衡逆向移動,條件為升高溫度;在2中,平衡時Z的物質(zhì)的量與原平衡相同,且速率加快,條件為加入催化劑;在3中,平衡正向移動,且速率加快,條件為加壓。


科目:高中化學 來源: 題型:
| tmin | Xmol | Ymol | Zmol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
 2Z
2Z 2Z
2Z
查看答案和解析>>
科目:高中化學 來源: 題型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

查看答案和解析>>
科目:高中化學 來源: 題型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |

查看答案和解析>>
科目:高中化學 來源: 題型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |

查看答案和解析>>
科目:高中化學 來源: 題型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

 2Z
2Z 2Z
2Z查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com